2020 年 12 月 12 日,高博医学论坛——精准诊断与治疗专场完美落幕,众多领域内知名诊断及临床专家共话精准诊断与治疗。会议内容涵盖领域内最新前沿研究及临床实践经验分享。幼年粒单核细胞白血病(J
2020 年 12 月 12 日,高博医学论坛——精准诊断与治疗专场完美落幕,众多领域内知名诊断及临床专家共话精准诊断与治疗。会议内容涵盖领域内最新前沿研究及临床实践经验分享。
幼年粒单核细胞白血病(JMML)是一种不常见的白血病,主要发生于 2 岁左右儿童。JMML 的治疗仍然是目前临床难点,造血干细胞移植如何发挥更大作用挽救患儿生命?本次会议上,高博医学(血液病)研究中心彭智勇主任分享了《造血干细胞移植治疗幼年粒单核细胞白血病》精彩报告。现将内容整理如下,以飨未能参会的专家。
JMML 发病率并不高,约占儿童恶性肿瘤 2-3%,属于罕见病范畴,中位发病年龄约为 2 岁,男性发病率为主。2016 年 WHO 将 JMML 归属到 MDS/MPN 范畴,JMML 是一种以粒细胞和单核细胞两系增生为主的儿童克隆性造血疾病。JMML 发病特点包括单核细胞的增高、脾大、贫血等,也有部分病例表现为不典型的皮疹。
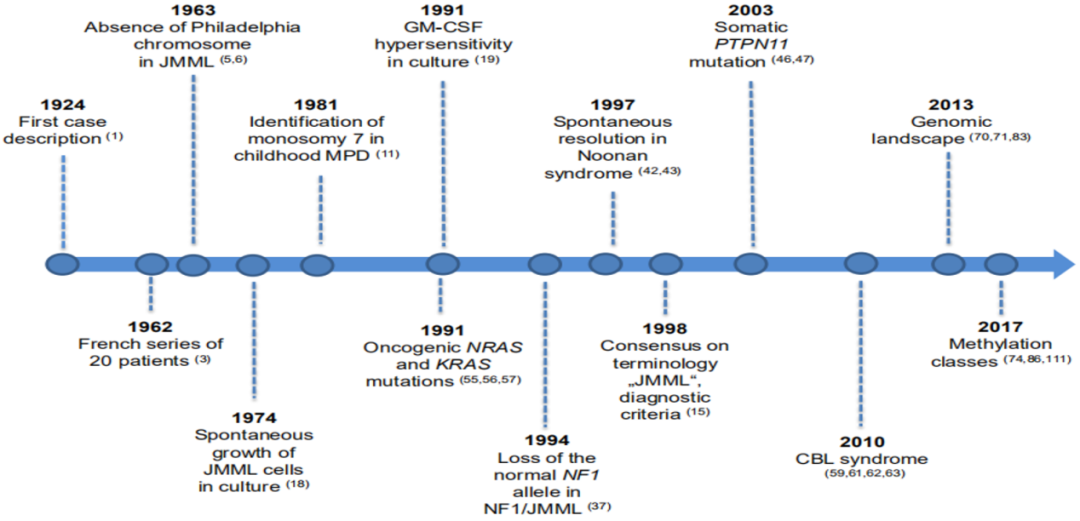
JMML 发展史
我们对 JMML 的认识已经有近百年历史,近些年来随着检测手段的进步,我们逐渐了解了 JMML 分子基因特征,诊断也随之不断更新变化。
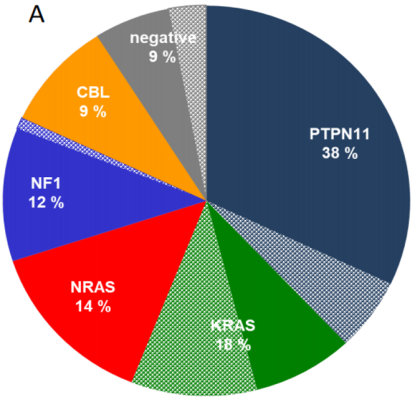
JMML 的驱动基因突变
超过 90% 的 JMML 患者存在 5 种驱动基因调控包括 PTPN11、KRAS、NRAS、NF1、CBL,这 5 种驱动基因主要集中在 RAS 信号通路上,RAS 信号通路的异常激活,最终导致临床功能的改变,因此,JMML 的临床表现常与自身免疫疾病的临床表现有相重叠。

2016 WHO 幼年粒单核细胞白血病诊断标准
JMML 的诊断主要包括三个方面,临床表现、基因特征以及除五种主要基因突变外其他细胞遗传学特征等。近年来,关于 JMML 表观遗传学研究热点主要集中在 DNA 甲基化方面,有许多研究显示,DNA 甲基化程度与 JMML 进展、预后密切相关。
JMML 的治疗现状
在 JMML 的治疗方面,目前的治疗手段十分有限,尚无标准化治疗方案,只有异基因造血干细胞移植被证实能够治愈,但其 EFS 仅为 55%。如果不进行治疗干预,大部分 JMML 患者生存时长不到 1 年;如果不进行移植,十年生存率仅 6%。另外,有 30-50% 的患者治疗后复发是治疗失败的主要原因,另外有 15% 左右会转化成为 AML。
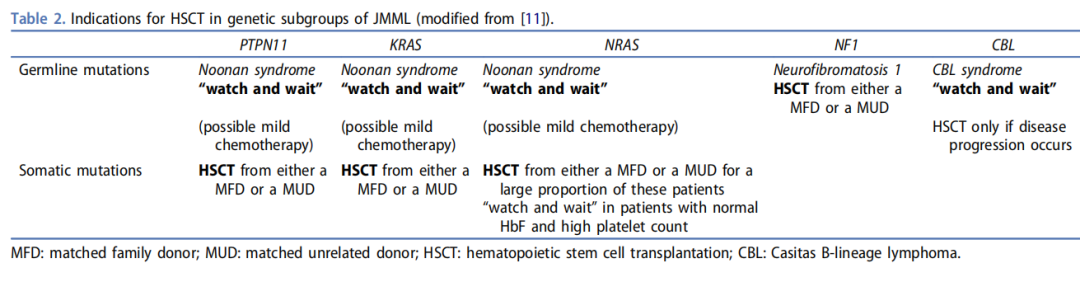
JMML 治疗策略
对于胚系突变与体细胞突变的患者,以及不同基因位点突变的患者,治疗建议也有所不同。从基因组学层面,对患者移植指征进行分层,分为低危、中危和高危。如胚系突变的 PTPN11、KRAS、NRAS 等就不需要进行移植,可以先等待和观察,随着时间的推移,可能会慢慢自我缓解。
而体细胞突变的 PTPN11、KRAS 就需要进行移植治疗,NRAS 仅少部分需要做移植,还有一部分会自愈;CBL 通常不建议做移植,但如果疾病仍然进展,也需要尽早考虑移植治疗。
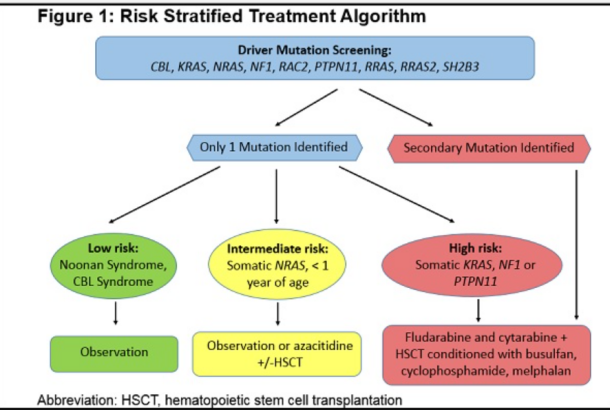
JMML 患者风险分层
一项早期研究数据显示,JMML 患者采取异基因造血干细胞移植治疗 EFS 仅为 52%,OS 为 64%,移植复发率高达 35%,移植死亡率是 13%。另一项来自国际多中心的脐血移植的回顾性研究显示,5 年生存率仅 22%,5 年 DFS 为 44%。
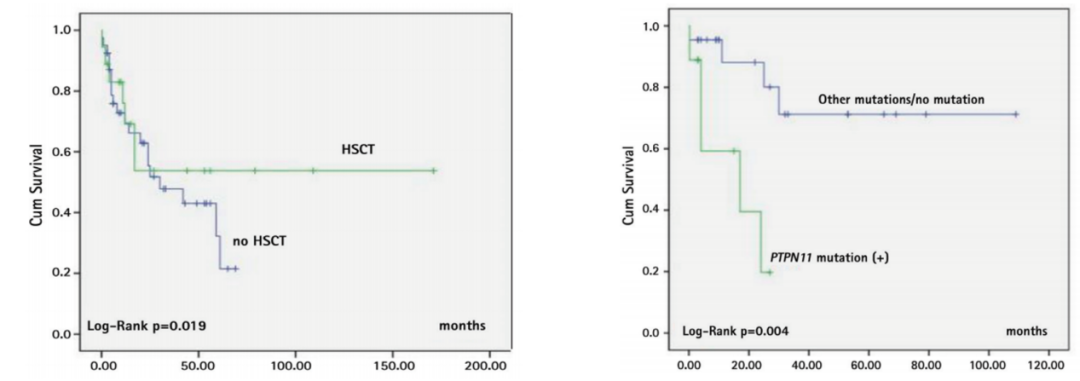
对年龄进行分层分析发现,小于 1.4 岁的患者 EFS 明显优于超过 1.4 岁的患者。2018 年来自土耳其一项回顾性研究显示,移植患者的生存优于非移植患者;非 PTPN11 突变患者的生存优于 PTPN11 突变患者。
国内一家中心研究报道的数据显示,单倍体造血干细胞移植治疗幼年型单核细胞白血病的 2 年 OS 达 75%,2 年 DFS 达 67%,但 aGVHD 也高达 92%,3-4 度 aGVHD 达 42%;而且病例数也很少。
JMML 患者移植前是否应该进行治疗(化疗)?
目前,JMML 患者尚无移植前标准化疗方案。早期研究显示,移植前化疗对移植后复发无影响。但后来的研究数据显示高强度化疗与长期生存相关(COG 的早期数据),另外一篇报道也提示对于移植前无化疗分子学反应的患者,强移植预处理强度无法改善预后。
李春富教授彭智勇主任团队于 2019 ASH 会议上报告的一项研究显示,JMML 移植前应用 DAC+Flag 进行治疗是安全、有效的(93.9%),移植前使用该方案可以提高 JMML 患者移植总生存(OS)。
移植前化疗策略包括传统化疗、去甲基化治疗、靶向治疗及一些其他疗法。传统化疗主要采取氟达拉滨与高剂量阿糖胞苷联合;去甲基化主要应用地西他滨、阿扎胞苷等药物;靶向药物主要围绕 RAS 信号通路发挥作用。
关于移植前是否需要切脾目前尚无统一定论。切脾的优点是可以减轻移植前肿瘤负荷、移植后对血小板的依赖较小,但同时切脾也会带来出血及长期感染风险。
高甲基化对移植患者生存具有不良影响,还将增加移植后复发风险。另外,PTPN11、SETBP1 基因突变的患者预后更差,并且基因突变的数量越多,预后越差。
高博南方春富(儿童)血液病研究院 JMML 移植的探索
李春富教授彭智勇主任团队的研究纳入了 95 例 JMML 患者,其中互补移植(李春富教授首创单倍体+无关脐血移植)70 例,无关全相合移植 10 例,无关脐血移植 15 例,中位确诊年龄 22 个月,主要基因型为 PTPN11、NRAS 突变及复合突变。移植前统一采用了中强度的化疗。
研究结果显示,中位随访 19 月(1.5-79 月),OS 达 92.7%,EFS 为 89%,非复发死亡率:5.2%。无关全相合、互补移植、脐血移植三种移植方案间无明显差异。Ⅱ-Ⅳ度 aGVHD 发生率 34%,Ⅲ-Ⅳ度为 10.6%,cGVHD 为 17%。
互补移植、无关全相合移植、脐血移植亚组也取得了很好的获益。
互补移植组中,5 年的 OS 和 EFS 均超过 90%,虽然脐血与单倍体植入组比较没有在 EFS 显示优势,但今年更新的数据相比去年 ASH 报道的数据,P 值越来越有接近显著差异的趋势;
无关供者移植组虽然只有 10 例患儿,但达到 100% 的无病生存。
总的来说,去甲基化药物与 HSCT 联合应用在 JMML-HSCT 中显示了令人鼓舞的结果。
总结
异基因造血干细胞移植仍然是 JMML 的主要根治手段,但报道的治疗总体疗效并不是很理想。对于少部分患儿来说,是否进行移植仍然存在争议,可参考风险分层来进行指征的评判。高博南方春富(儿童)血液病研究院通过优化 JMML 移植方案获得良好效果,提示移植前化疗可能使患者获益,此外,移植前、后的去甲基化治疗可能发挥重要作用。
专家简介

彭智勇,高博医学(血液病)广东研究中心南方春富(儿童)血液病研究院副主任医师。
2017 年「宋庆龄儿科医学奖」集体获得者之一。广东省地贫防治协会治疗专业委员会委员,广东省抗癌协会小儿肿瘤专业委员会第一届青年委员会常委,广东省抗癌协会神经肿瘤专业委员青年委员,广东省医学会罕见病学分会第一届委员会免疫病学组成员。
从事临床工作 16 年,主要研究方向为儿童血液病、造血干细胞移植,临床经验较丰富;主持省市级课题各一项,参与多项国家课题,参与广州市科技项目健康医疗协同创新二期重大专项课题:
「基于干细胞技术的地中海贫血治疗策略与临床方案」( 项目编号:201508020258),并完成国内首例基因修饰的造血干细胞移植治疗地中海贫血。主持及参与发表论文 20 余篇,SCI 2 篇。
目前主攻治疗幼年粒单核细胞白血病,其临床治疗结果达到国际领先水平,成果 2 次在 ASH 作为 poster 报道,并多次在全国性血液会议做口头报道。
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
好文章,需要你的鼓励
















