来源:首都医学科学创新中心
CAR-T 疗法在血液肿瘤中战绩赫赫,为何在更为常见的肺癌、肝癌、胃癌等实体瘤面前却显得力不从心?是 CAR-T 本身潜力耗尽,还是我们尚未找到打开实体瘤大门的正确钥匙?首都医科大学/首都医学科学创新中心周欣团队通过一篇深度综述,系统拆解了 CAR-T 在实体瘤中面临的四大壁垒,并指明了通过合成生物学进行「智能升级」的破局之路。
CAR-T(嵌合抗原受体 T 细胞)疗法在血液肿瘤领域是革命性的,但当战场转向占癌症 90% 以上的实体瘤时,其疗效却大幅折扣。这并非 CAR-T 的「天赋」不足,而是实体瘤构筑了远比血液肿瘤复杂得多的「防御工事」。近日,首都医科大学/首都医学科学创新中心周欣研究员团队在 Acta Biochimica et Biophysica Sinica 上发表的综述,就像一份详尽的「军事地图」,不仅清晰标出了 CAR-T 在实体瘤战场遭遇的重重关卡,更给出了打造下一代「超级 CAR-T」的升级蓝图。本文将为您梳理其中核心洞察,聚焦 CAR-T 疗法攻坚实体瘤的未来方向。周欣实验室博士研究生陈醉为本文第一作者,周欣为通讯作者。

孤军深入:CAR-T 在实体瘤中的「水土不服」
CAR-T 细胞像一支装备了「精准制导系统」的特种部队。它能通过其表面的 CAR 蛋白直接识别肿瘤细胞表面的特定抗原,从而高效激活、扩增,发起致命攻击。这套机制在癌细胞弥散的血液肿瘤中如鱼得水。然而,实体瘤则是一个高度组织化、防御严密的「堡垒」,让擅长「运动战」的 CAR-T 部队举步维艰:
难以浸润的「铜墙铁壁」:实体瘤被致密的基质细胞和紊乱的血管包裹,CAR-T 细胞很难穿透这层物理屏障,无法抵达肿瘤核心区域。
抑制性微环境的「毒气战场」:即便少数 CAR-T 细胞成功潜入,也会发现身处一个「毒气室」——充满了调节性 T 细胞、髓源性抑制细胞以及各种免疫抑制因子,使其功能被严重抑制,甚至「瘫痪」。
激烈代谢竞争的「粮草断绝」:肿瘤细胞疯狂掠夺周围的葡萄糖和氨基酸等关键营养,导致 CAR-T 细胞「饥肠辘辘」,能量耗竭,丧失战斗力。
抗原异质性与丢失的「伪装逃脱」:肿瘤细胞并非均一的,有些会下调或完全丢失 CAR-T 所靶向的抗原,使得 CAR-T 细胞失去目标,导致治疗失败和复发。
对比与启示:相较于 TCR-T,CAR-T 的优势与短板
为了更好地理解 CAR-T 的挑战,我们不妨将其与另一种重要的细胞疗法 TCR-T 进行简要对比。
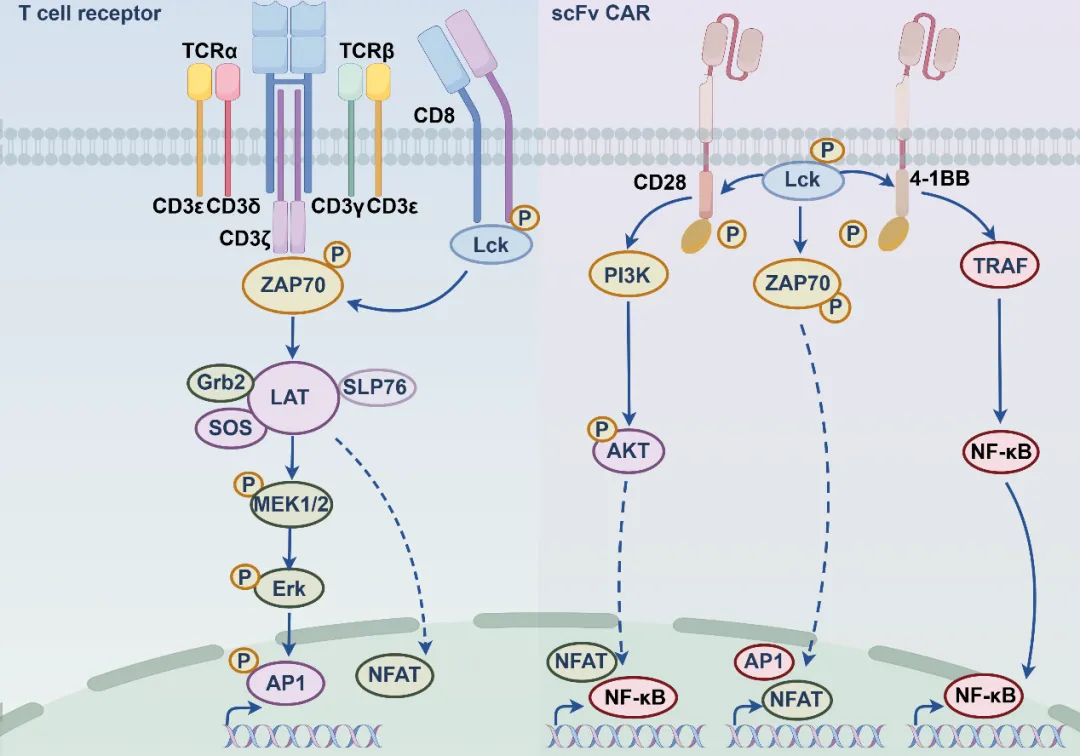
CAR-T 的优势在于「灵活直接」:它不依赖于 MHC 呈递,能够直接靶向细胞表面蛋白,避免了因肿瘤 MHC 下调而失效的风险,且设计相对通用。
CAR-T 的短板在于「信号简单:其激活信号过于「直白」,缺乏天然 T 细胞受体那种精密的调控机制,容易导致电紧张信号,即使没有肿瘤抗原刺激也处于低度激活状态,结果就是 CAR-T 细胞提前耗竭,影响长期持久性。由此可见,攻克实体瘤的关键,并不是放弃 CAR-T,而是如何针对其短板,对其进行「基因改造」和「战略升级」,使其更加适应实体瘤所处的恶劣环境。
核心升级:优化「动力系统」——共刺激域的选择
共刺激域是 CAR 的「发动机」,直接决定 CAR-T 细胞的战斗力续航能力。选择不同的共刺激域,如同为部队选择不同的动力方案:
CD28 域:强劲推力,适合「闪电战」。它能提供强大的初始激活信号,适合需要快速缩小肿瘤体积的情况,但可能续航不足,易导致细胞耗竭。
4-1BB 域:持久续航,适合「持久战」。它能更好地促进记忆性 T 细胞形成和代谢适应,增强 CAR-T 细胞的持久性,有利于长期控制病情,但起效可能较慢。
新兴共刺激域(如 ICOS, OX40, HVEM):特种功能。它们各有专长,例如 ICOS 有助于辅助 T 细胞的调节,OX40 有助于逆转 T 细胞衰竭,HVEM 可改善细胞代谢适应能力,为应对特定挑战提供了更多武器。未来的设计趋势是根据肿瘤类型和治疗目标,进行「量体裁衣」式的组合选择。
破局之路:多维度打造「超级 CAR-T」
周欣团队的综述指出,突破实体瘤壁垒需要一套组合拳,从多个维度对 CAR-T 进行智能化升级:
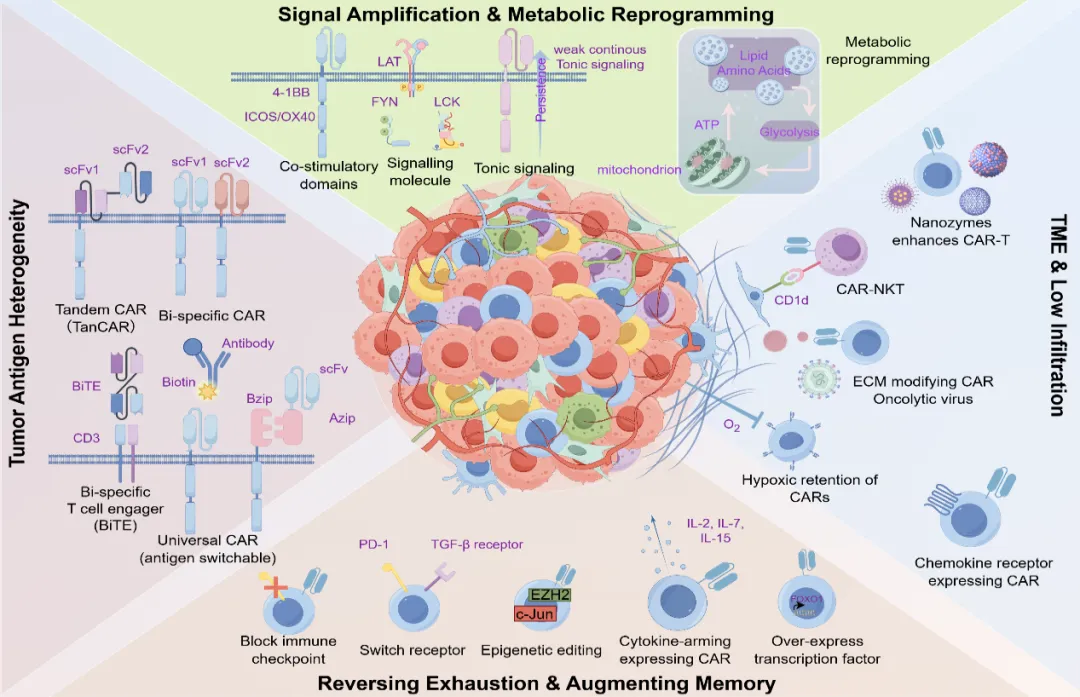
双靶点 CAR,上「双保险」:同时靶向两个肿瘤相关抗原,可有效应对肿瘤抗原逃逸,显著降低复发风险。
代谢重编程,解决「粮草问题」:通过基因工程增强 CAR-T 细胞的线粒体功能,使其能够利用替代能源,在营养匮乏的肿瘤微环境中「自力更生」。
表观遗传编辑,逆转「耗竭状态」:利用 CRISPR 等技术敲除 TET2、抑制 EZH2 等表观遗传调控因子,从根源上延缓或逆转 CAR-T 细胞的功能耗竭,赋予其更长的战斗寿命。
联合疗法,多兵种协同作战:
联合放疗:破坏肿瘤基质屏障,并诱发免疫原性细胞死亡,为 CAR-T 细胞开路。
联合免疫检查点抑制剂:解除肿瘤微环境的免疫抑制,解放 CAR-T 细胞的战斗力。
智能可控系统,实现「精准点杀」:逻辑门控 CAR:例如 SynNotch CAR,要求肿瘤细胞同时表达两种特定抗原才会被激活,极大提高了安全性,避免误伤正常组织。另外通过外部光源或超声波远程精确控制 CAR-T 细胞的活性的光控/声控 CAR,也可以实现按需激活,随时叫停,最大化控制副作用。
新兴细胞疗法:CAR-NKT(基于自然杀伤 T 细胞的嵌合抗原受体细胞疗法)展现出显著优势:其依托肿瘤微环境中的 CD1d 依赖性免疫反应,在体内实现了优异的抗肿瘤活性。具体而言,CAR-NKT 细胞能够精准清除表达 CD1d 分子的 M2 型巨噬细胞及髓系衍生抑制细胞,瓦解肿瘤的免疫抑制屏障;进一步地,它还能促进表位扩散,并激活内源性 T 细胞对肿瘤相关新抗原的免疫应答,形成 「靶向清除+免疫记忆激活」 的双重抗肿瘤效应。
未来展望:CAR-T/NKT 的智能化与集成化
周欣团队描绘的未来图景是,CAR-T/NKT 将不再是单一的「武器」,而是一个可编程、可调控、模块化的「活体药物」平台。
AI 驱动设计:利用人工智能预测最优靶点、设计更安全高效的 CAR 结构,大幅缩短研发周期。
模块化集成:将不同功能模块集成到 CAR-T/NKT 细胞中,使其既能杀伤肿瘤,又能改造微环境,还能根据情况自我调节。
周欣研究员表示:「CAR-T/NKT 疗法在实体瘤领域的挑战是巨大的,但前景同样广阔。我们现在的努力,就像是给 CAR-T/NKT 这支『特种部队』配备更先进的装备、更详尽的战场地图和更可靠的后勤支持。通过生物工程学的智慧,我们坚信能够突破壁垒,让 CAR-T/NKT 疗法惠及最广大的实体瘤患者。」
本文基于周欣研究员团队发表于 Acta Biochimica et Biophysica Sinica 的综述「Decoding Signaling Architectures: CAR vs TCR Dynamics in Solid Tumor Immunotherapy」进行整理,旨在科普前沿进展,具体治疗方案请务必遵从主治医师的指导。
好文章,需要你的鼓励
















