近日,高博诊断中心流式细胞实验室喻新建主任团队创新性改良探索的组织流式细胞术(FCM)鉴定无骨髓及浆膜腔受累因而无法获得液体标本的复发/难治性(R/R)B 细胞恶性肿瘤的靶抗原技术成果在线发表于 CYTOMETRY PART B-CLINICAL CYTOMETRY 杂志。
通过快速、有效地检测,克服了免疫组织化学(IHC)耗时长的局限性,为急需尽快接受嵌合抗原受体 T 细胞(CAR-T)治疗的复发/难治性 B 细胞恶性肿瘤患者赢得了更多宝贵时间。

研究简介
1、研究方法
2017 年 10 月至 2020 年 6 月共纳入了 68 例无骨髓(BM)和浆膜腔积液(SCE)侵犯的 R/R B 细胞恶性肿瘤患者,采用细针或粗针穿刺活检获取新鲜肿瘤组织标本,在 CAR-T 治疗前进行靶抗原鉴定。
具体方法为:将组织标本放入含 2% 胎牛血清的生理盐水,迅速送至 FCM 实验室,并立即处理。从组织中分离出细胞,制成细胞悬液,细胞浓度为 104/ml~106/ml。细胞悬液制备流程见图 1。
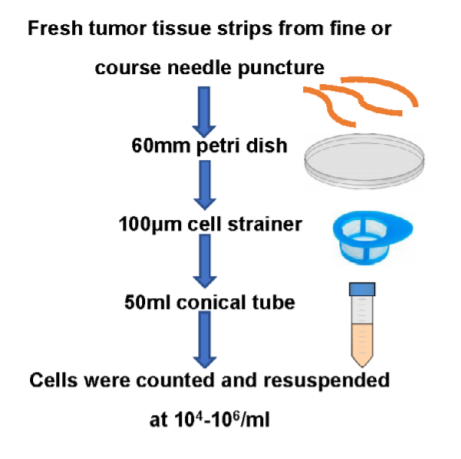
标准抗体 panels 包含前体 B 细胞的 CD10/CD20/CD34/CD19/CD38/CD45,以及成熟 B 细胞的κ/λ/CD10/CD19/CD20/CD38/CD45。同时可根据患者初始诊断的免疫表型添加其他抗体。抗原表达、部分表达、不表达分别定义为表达细胞比例>80%、20%~80% 和<20%。
2、研究结果
基线资料
68 例患者中,1 例标本仅有细胞碎片、无细胞,4 例无肿瘤细胞,最终 63 例标本满足 FCM 分析条件。
63 例患者中,11 例为 B 细胞急性淋巴细胞白血病(B-ALL);52 例为 B 细胞非霍奇金淋巴瘤(B-NHL),包括 34 例弥漫性大 B 细胞淋巴瘤(DLBCL)、13 例伯基特淋巴瘤和 5 例其他类型淋巴瘤。中位年龄 41 岁(1~71 岁),包括 47 例成人、16 例儿童(18 岁以下)。所有患者均为多线治疗失败,经治方案包括化疗、局部放疗、干细胞移植、抗体类免疫治疗或 CAR-T。
检测结果
获取细胞:42 例患者的组织标本来源于体表肿块,21 例源于内部器官;43 例采用细针穿刺,20 例经粗针穿刺。
从这些组织标本中获取的细胞数量从每管 1000 个到大于 100000 个不等(5 例<5000、17 例>100000);可用于分析的肿瘤细胞占比为 0.03%~99.44%(5 例<5%、13 例>90%)。
抗原表达: 除了 1 例既往接受过 CD19 CAR-T 治疗的 B-ALL 患者以外,其余 62 例患者均表达 CD19。11 例 B-ALL 患者、10 例 B-NHL 患者不表达或部分表达 CD20。2 例 B-ALL 患者、7 例 B-NHL 患者部分表达 CD22。见图 2 和图 3。
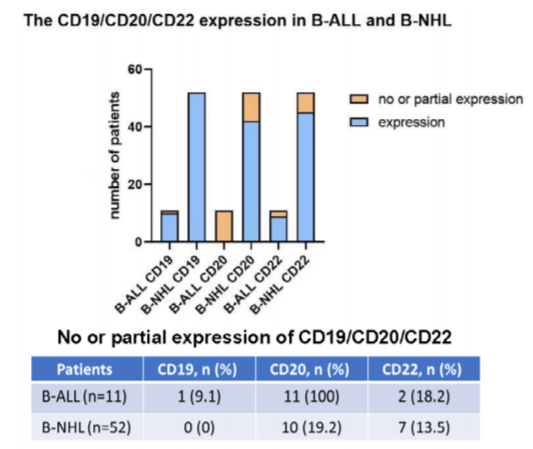
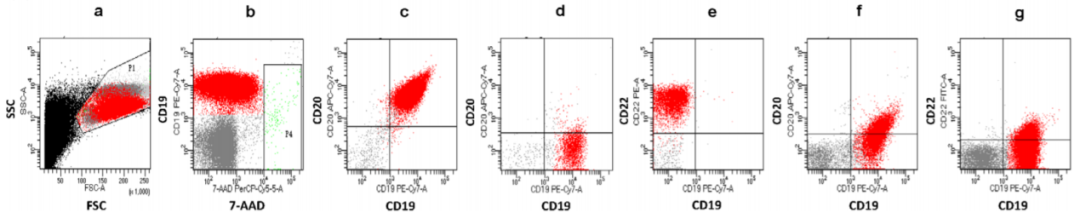
FCM 与 IHC 一致性:63 例组织标本中,46 例同期送检了 IHC 染色、检测 CD19/CD20/CD22 表达,其中 1 例未找到肿瘤细胞。
在 45 例同时具有 FCM 和 IHC 检测结果(两种方法的结果判定标准相同)患者中,CD19、CD20、CD22 表达结果一致率分别为 93.3% (42/45)、84.4% (38/45) 和 88.9% (40/45)。
部分 CD20/CD22 不一致的原因主要在于:用于 IHC 检测的 CD20/CD22 抗体可以同时检测胞膜和胞浆内的抗原;而用于 FCM 检测的抗体可以只检测胞膜上的抗原,因此 FCM 可以更准确地指导 CAR-T 的靶点选择。
研究解读
1、准确鉴定靶抗原——CAR-T 治疗的关键
近年来,CAR-T 被广泛应用于 R/R B 细胞恶性肿瘤治疗,包括 B-ALL、B-NHL。CAR-T 靶点的选择,取决于肿瘤细胞靶抗原的表达特征。
因此,准确鉴定肿瘤细胞上靶抗原的表达水平,对于 CAR-T 的疗效至关重要。如果靶抗原不表达或仅部分表达,则 CAR-T 会无效或疗效有限。尤其是既往接受过抗体免疫治疗或 CAR-T 治疗的患者,常常存在相关抗原的丢失或减少,准确的抗原鉴定尤为关键。
2、破解 IHC 耗时长,组织 FCM 另辟蹊径
肿瘤细胞表面靶抗原鉴定通常是对液体标本(BM 或 SCE)进行多参数 FCM 检测,或对组织标本进行 IHC 染色检测。然而,部分 R/R B 细胞恶性肿瘤患者仅有髓外病灶,BM 和 SCE 中没有肿瘤细胞,无法进行常规流式分析。
由于肿瘤进展迅速,这些患者急需尽快获知 CAR-T 靶抗原、尽早治疗,而 IHC 检测费时、常需等待数天。
组织 FCM 分析已与形态学检查一起被用于淋巴瘤诊断,通常采用外科活检或穿刺活检,本研究创新性利用穿刺标本快速鉴定肿瘤细胞 CD 抗原,为 CAR-T 治疗选择靶点提供依据。所有 FCM 结果在<4~6 小时即可获得,远远快于耗时数天的 IHC 染色,且更准确。
3、掌握技术要点,确保组织 FCM 成功率
从组织中分离细胞,酶处理法和物理机械法均是可行的。酶解消化法(胰蛋白酶、胃蛋白酶或胶原酶)会增加组织细胞释放,但常常导致细胞高损伤、低存活,因此其适用于组织标本充裕的情况。
为了从有限的穿刺标本中获取更多细胞,本研究采用了柔和的机械技术,利用注射器活塞轻柔地按压组织,并用生理盐水反复冲洗。
此外,将穿刺标本置于含胎牛血清的生理盐水妥善保存并及时送到实验室,以及实验室收到标本后马上处理,均有利于保留更多的活细胞。
这一改良的流程使得高达 92.6%(63/68)的标本都具有充足的细胞进行 FCM 分析。4 例无肿瘤细胞的标本,可能的确是没有肿瘤细胞,也可能是有限的肿瘤细胞被破坏或溶解。
4、匠心独运,流式新用:发挥独特优势,高效助力 CAR-T
从本研究数据可以看到,并非所有 R/R B 细胞恶性肿瘤患者均高表达 CD19/CD20/CD22。单一靶点的 CAR-T 治疗常常难以维持长期缓解,通过不同靶点联合的 CAR-T 有望延长患者生存。
因此,肿瘤细胞抗原鉴定对于临床医生选择单靶、双靶甚至三靶的 CAR-T 治疗策略十分重要。
FCM 在 CAR-T 治疗全程都可发挥重要作用。抗原表达检测方面,除用于治疗前的靶点筛选以外,FCM 对 CAR-T 之后序贯治疗方案的选择也能够提供有效帮助。
综上,正确选择靶抗原是 R/R B 细胞恶性肿瘤患者有效 CAR-T 治疗的基础,尤其是对于既往接受过抗体或 CAR-T 治疗的患者。
这一利用组织进行 FCM 检测肿瘤细胞靶抗原的改良方法,为 BM、SCE 无侵犯的 R/R B 细胞恶性肿瘤患者 CAR-T 治疗提供了快速(<4~6 小时)、准确的抗原鉴定,为肿瘤快速进展的患者前移了宝贵的治疗时机。
此项技术也可以拓展至其他抗原检测(如 CD79b、BCMA 或 CD7),从而为相应的 CAR-T 和抗体免疫治疗提供高效支持。
好文章,需要你的鼓励
















