来源:《临床儿科杂志》
郑诺, 陈曼, 张冬丽, 刘晓鸣. 1 例青少年难治性视神经脊髓炎谱系疾病的诊治 [J]. 临床儿科杂志, 2025, 43(4): 301-305 DOI:10.12372/jcp.2025.24e0688
ZHENG Nuo, CHEN Man, ZHANG Dongli, LIU Xiaoming. Diagnosis and treatment of one case of refractory neuromyelitis optica spectrum disorder in adolescents[J]. Journal of Clinical Pediatrics, 2025, 43(4): 301-305 DOI:10.12372/jcp.2025.24e0688
本文作者:郑 诺 陈 曼 张冬丽 刘晓鸣
作者单位:徐州市儿童医院(江苏徐州 221000)
摘要: 探讨奥法妥木单抗(OFA)治疗难治性视神经脊髓炎谱系疾病(NMOSD)患者的可行性和有效性。患儿,女,15 岁,血清水通道蛋白 4 抗体(AQP4-IgG)阳性多次复发的 NMOSD,曾先后给予静脉注射甲基泼尼松龙琥珀酸钠、免疫球蛋白、利妥昔单抗(RTX),并口服醋酸泼尼松、吗替麦考酚酯治疗 5 年,9 个月前开始间隔接受 4 剂 OFA 治疗(20 mg,皮下注射),观察患儿在 OFA 治疗的 9 个月期间 NMOSD 是否复发,血清 AQP4-IgG 抗体滴度,外周血 B 细胞水平以及头颅和脊髓 MRI 变化。患儿在 OFA 治疗的 9 个月期间症状稳定,无复发,血清 AQP4-IgG 滴度下降,复查头颅及脊髓 MRI 病灶减少,无新发病灶,耐受性好,无过敏反应或继发感染,除 B 细胞完全耗竭,未发现淋巴细胞减少或低丙种球蛋白血症。对于难治性 NMOSD 或其他免疫治疗不耐受的患儿,皮下注射 OFA 可能是一种安全有效的替代治疗。
关键词:奥法妥木单抗;水通道蛋白 4 抗体;视神经脊髓炎谱系疾病;难治性
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)是一种自身免疫介导的中枢神经系统炎症性脱髓鞘疾病,通常以视神经炎和纵向的长节段脊髓炎为特征 [1]。90%NMOSD 患者可检测到水通道蛋白 4 抗体(anti-aquaporin 4-immunoglobulin, AQP4-IgG),与 NMOSD 的发病与转归密切相关 [2]。NMOSD 复发率高、致残率高,如何预防复发是该病治疗的关键。目前,针对 NMOSD 的治疗主要包括免疫抑制剂、丙种球蛋白、糖皮质激素和血浆置换等方法 [3-4]。然而,对于部分难治性患者,这些常规治疗方法的疗效有限,且部分患者存在不耐受或严重的不良反应 [5]。因此,寻找新的有效治疗方法具有重要意义。B 淋巴细胞介导的免疫机制被认为在 NMOSD 的发病和发展中起着至关重要的作用 [6]。越来越多的人关注靶向 B 细胞耗竭的药物,奥法妥木单抗(ofatumumab, OFA)是一种完全人源化的抗 CD20 单克隆抗体,2021 年 12 月国家药品监督管理局批准 OFA 注射液用于治疗成人复发型多发性硬化(multiple sclerosis,MS),并显示出良好的疗效 [7]。在儿科,OFA 已被用于利妥昔单抗(rituximab,RTX)耐药肾病综合征 [8],国外罕见 OFA 用于 MNOSD 的个案报道 [9],国内尚未见关于儿童或青少年用于 NMOSD 疾病的报道。本文报道了 1 例青少年女性 NMOSD 患者的诊疗过程,初步探讨 OFA 治疗难治性复发性 NMOSD 患者的临床应用前景。
1 病例资料
患儿,女,15 岁,2018 年 2 月出现右眼视物有缺损,视力下降,伴眼球运动时疼痛,完善头颅及视神经 MRI 平扫提示大脑半球,小脑半球及下丘脑异常信号,右侧视神经颅内段、眶内段较对侧增粗,MRI 增强提示右侧视神经眶内段远端稍强化。脊髓 MRI:T6-T12 水平胸段脊髓内散在条片状稍长 T2 信号影,L1 水平脊髓内见小片状稍长 T2 信号,脑脊液及血清抗 AQP4 抗体 IgG 均阳性(1∶320),确诊 NMOSD(AQP4-Ab 阳性),外院予甲基泼尼松龙琥珀酸钠(20 mg/kg×3d、10 mg/kg×3d)联合丙种球蛋白(2 g/kg)静滴治疗,后予醋酸泼尼松序贯口服治疗,激素序贯治疗 2 周后加用吗替麦考酚酯胶囊口服(0.25 g/次,bid),患儿症状缓解,规律醋酸泼尼松减量治疗。2018 年 12 月患儿患「水痘」,停用醋酸泼尼松及吗替麦考酚酯胶囊。2019 年 2 月因颈肩痛入外院住院治疗,复查头颅 MRI 示左侧丘脑及右侧脑室体后部周围新发病变,血清抗 AQP4 抗体 IgG 强阳性(1∶1000),考虑疾病复发(第一次复发),入院后再次予甲基泼尼松龙琥珀酸钠(20 mg/kg×3d 逐渐减量)联合丙种球蛋白(2 g/kg)静滴治疗,后序贯口服醋酸泼尼松(45 mg/次,qd,1.2 mg·kg-1·d-1),吗替麦考酚酯胶囊(0.25 g/次,bid),出院后醋酸泼尼松按计划逐渐减量至 7.5 mg/次,qd,吗替麦考酚酯按计划逐渐加量至 0.625 g/次,bid。出院后患者症状缓解,无不适临床表现,2019 年 10 月停用醋酸泼尼松,吗替麦考酚酯胶囊逐渐减量(2 月减 0.25 g),减量 6 月余复查头颅 MRI 发现原病灶范围较前增大,并出现新发病灶,复查血清抗 AQP4 抗体 IgG 阳性(1∶320),再次加回原剂量(0.625 g/次,bid)。2021 年 3 月因右拇趾麻木感 2 月,眼球活动时眼胀 1 周入院, 复查头颅 MRI 提示颅内较多新发病灶,局部旧病灶较前范围增大,全脊髓 MRI 示 T7 -T10 水平胸段脊髓内条片状长 T2 信号较前范围增多,复查血清抗 AQP4 抗体 IgG 阳性(1∶320),考虑再次复发(第二次复发),予以丙种球蛋白(2 g/kg)静滴,甲基泼尼松龙琥珀酸钠(20 mg/kg×3d,逐渐减量)免疫治疗,后改为醋酸泼尼松(45 mg/次,qd,1 mg·kg-1·d-1)口服,考虑已予吗替麦考酚酯胶囊口服治疗 3 年余仍存在复发,建议停用,后续调整为 RTX(500 mg/次)应用预防复发(计划每周 1 次,共 3~4 次)。患者在应用 RTX 第三疗程中出现过敏反应,后停用,继续口服醋酸泼尼松(45 mg/次,qd),出院时患者症状缓解,定期随诊病灶较前缩小。2021 年 8 月患者出现日间睡眠增多,诉咽部不适,有一过性低热,最高体温 37.8℃,复查头颅 MRI 示病灶较前范围明显增多,眼眶 MRI 示右侧视神经眶内段较左侧稍增粗,考虑病情再次复发(第三次复发),继续口服醋酸泼尼松(15 mg/次,qd),再次加用吗替麦考酚酯胶囊(0.5 g/次,bid),间断予丙种球蛋白治疗,分别在 2021 年 8 月予丙种球蛋白(2 g/kg)治疗,2022 年 1 月予丙种球蛋白(1 g/kg)治疗。2023 年 9 月复查头颅 MRI 示小脑等多处新发病灶,但患者无临床症状,2023 年 10 月复查颅 MRI 示左侧小脑半球、桥臂、右侧颞叶及额顶叶病灶较前有所增多,继续予丙种球蛋白(2 g/kg)治疗,同时口服吗替麦考酚酯胶囊(0.75 g/次,bid),醋酸泼尼松(10 mg/次,qd)。2023 年 12 月患者出现近期记忆力下降及头痛,复查头颅 MRI 提示左侧小脑半球,右侧颞枕叶及胼胝体压部新发病灶(见图 1),血清抗 AQP4 抗体 IgG 强阳性(1∶1000),至本院就诊。根据患者有新的症状及影像学改变,且血清抗 AQP4 抗体强阳性 [10],考虑患者再次复发(第四次复发)。因患者经激素冲击和序贯治疗、间断丙种球蛋白及吗替麦考酚酯等治疗效果不佳,且对 RTX 过敏,故给予 OFA 治疗(20 mg,皮下注射),吗替麦考酚酯胶囊(0.75 g/次,bid)每周减 0.25 g,逐渐减停,后醋酸泼尼松逐渐减量。随访 9 个月,使用 CD19+B 细胞作为监测指标(>1%,接续下一针),间隔接受 4 剂 OFA,临床无不适表现,血清 AQP4-IgG 滴度下降(1∶100),复查头颅及脊髓 MRI 病灶范围减小,无新发病灶(见图 2),耐受性好,无过敏反应或感染性事件,除 B 细胞完全耗竭,未发现淋巴细胞减少或低丙种球蛋白血症。患儿诊疗时间轴见表 1。
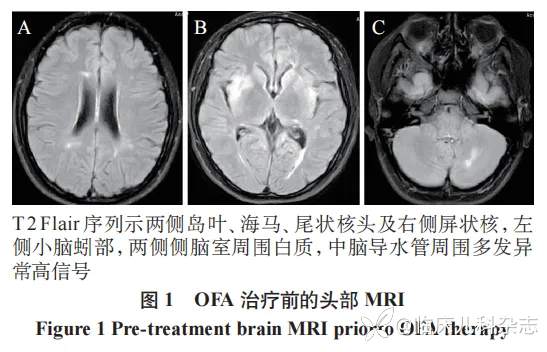
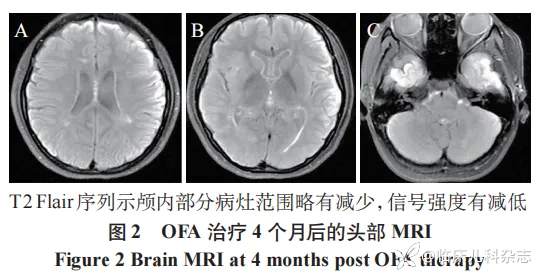

2 讨论
由于 NMOSD 是一种 T-B 细胞介导的疾病 [6],这为临床治疗方案的选择开拓了新思路。利用耗尽抗体(如 RTX 和 OFA)靶向 B 细胞已成为炎症性脱髓鞘疾病(如 MS、NMOSD 等)的国际研究热点 [11-12]。CD20 在幼稚 B 细胞到成熟 B 淋巴细胞各个阶段的 B 细胞的细胞膜上表达,但也在不到 5% 的 T 淋巴细胞中表达。第一代以 CD20 为靶点的抗体药物 RTX,是一种抗 CD20 的嵌合单克隆抗体,主要作用机制是通过直接细胞毒性、抗体依赖细胞介导的细胞毒性(antibody-dependent cellular cytotoxicity,ADCC)、抗体依赖细胞介导的吞噬作用(antibody-dependent cellular phagocytosis,ADCP)及补体依赖的细胞毒性(complement-dependent cytotoxicity,CDC)耗竭 CD20+B 淋巴细胞 [13-14]。尽管 RTX 在预防 NMOSD 复发方面有很好的疗效,但超过 10% 的治疗儿童出现了严重输注相关的不良事件和感染风险 [4,15],这表明需要另一种更好的耐受性相关的 B 细胞靶向治疗。
鉴于静脉注射 B 细胞耗竭剂的使用可能会受到输注相关不良事件的限制,改进的药物正在出现。OFA 是第二代抗 CD20 单抗,其作用机制与 RTX 相似,但在 CD20 结合位点上与 RTX 不同。RTX 与 CD20 的大的细胞外环结合,而 OFA 与大和小的细胞外环结合,OFA 与 CD20 的结合更紧密,其解离速度较慢。因此,它比 RTX 发挥了更有效的 CDC 作用 [16-17]。更有研究表明,OFA 可使血清 IgG 平均水平保持稳定达 3.5 年,IgM 平均水平在正常值下限(lower limit of normal,LLN)以上,有效降低感染的风险 [18]。此外,OFA 的独特之处在于它是完全人源化的,防止了抗药物抗体产生的风险,并有一个改进的皮下注射给药途径,注射相关的全身反应更少。总之,它的不良反应风险较低,同时使用方便,OFA 可能是 NMOSD 患者的一种潜在的新选择。
对于使用哪种生物标志物来监测 B 细胞耗竭剂的疗效,目前还没有达成共识 [19-21]。在本病例报告中,使用 CD19+B 细胞作为监测指标。目前,第一代抗 CD20 单抗(RTX)在 NMOSD 中的研究相对成熟,既往研究证实,使用 B 细胞监测 RTX 的生物功效有助于减少平均注射 RTX 的次数 [19]。根据 B 细胞的监测水平延长给药时间,进行个体化、准确的治疗,也可以保证疗效。因为 OFA 是第二代抗 CD20 单抗,其作用机制与第一代相似,也可以以类似的方式进行尝试。动态监测 CD19+B 细胞的水平,并尝试延长标准给药间隔,它将在减少医疗成本和药物造成的不良反应方面有重要意义。
2021 年新的指南对于 NMOSD 患者的预防复发已经提出了更前沿的治疗方法 [22-23],但目前国内外尚缺乏 OFA 治疗 NMOSD 的临床报道和大型研究,本病例应用 OFA 后疗效良好,耐受性好,无过敏及低丙种球蛋白血症等不良反应,为青少年 NMOSD 的治疗提供了新的思路,对于难治性 NMOSD 患者或其他免疫治疗有不耐受的情况,皮下 OFA 可能是一种安全有效的替代治疗。然而 MNOSD 复发率高,40%~60% 在 1 年内复发,约 90% 在 3 年内复发,约 50% 患者在病程 5~10 年遗留视觉功能或运动功能障碍 [24-25],对于此病例的随访时间仅 9 个月,关于其确切疗效,能否达到长期缓解及预防复发,患者的治疗和随访仍在进行中。未来治疗的重点仍然是根据血清中密切监测的 CD19+B 细胞的水平,动态调整 OFA 的给药间隔。我们将进一步评估其安全性和有效性,并逐步将该治疗策略扩展到其他 NMOSD 患者,形成探索性的病例系列或临床研究。
好文章,需要你的鼓励
















