来源:雨露肝霖
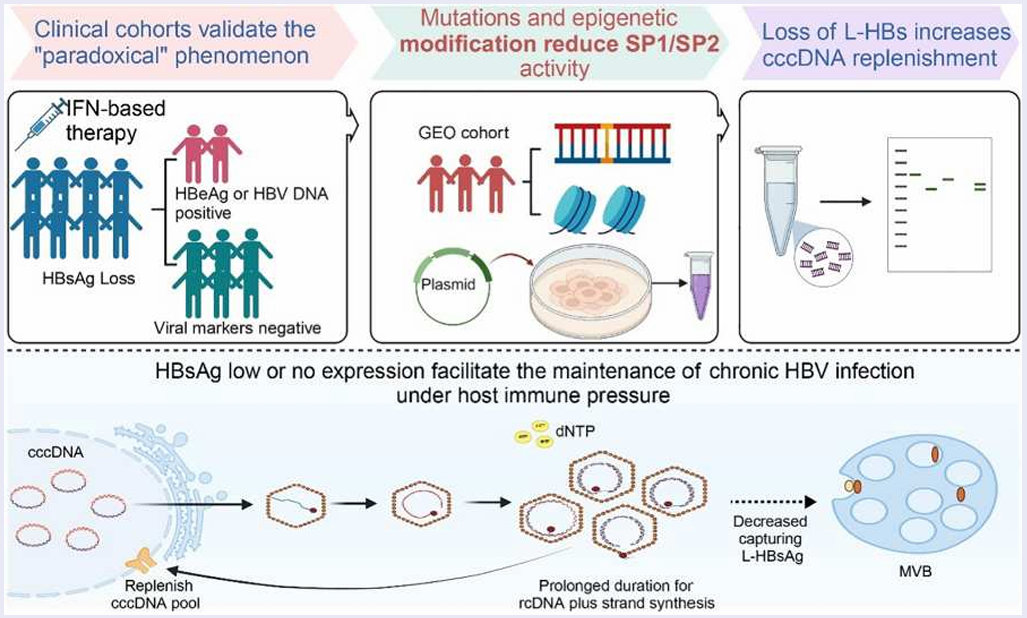
临床治愈是当前慢乙肝最理想的治疗终点,而聚乙二醇干扰素α(PEG IFNα)是目前追求临床治愈的最佳选择。在 PEG IFNα治疗过程中,一部分患者可能出现 HBeAg 清除迟于 HBsAg 清除的情况,这其中的原因是什么呢?对此,北京大学医学部鲁凤民教授、香港大学袁孟峰教授及首都医科大学附属北京佑安医院曹振环教授联合在 Emerging Microbes & Infections 上发表了相关研究,深入探索了接受基于 PEG IFNα治疗的慢乙肝患者获得 HBsAg 清除后出现 HBeAg 和/或 HBV DNA 延迟清除的具体机制。
关于这种临床现象,文章提出三种可能的原因:(1)部分慢乙肝患者可能感染了病毒变异株,产生抗原修饰的 HBV s 蛋白,无法被现有的 HBsAg 检测方法检测到;(2)表观遗传组蛋白修饰或基因突变机制可能导致 cccDNA 中 SP1/SP2 启动子的选择性转录活性下调或缺失;(3)SP1/SP2 启动子的突变可能降低其活性,导致在 HBeAg 和 HBV DNA 转阴前就出现了 HBsAg 清除。

基于一系列分子学、细胞学层面的研究结果,推测其中的机制为:
在宿主免疫压力下,HBV 经历一系列变化以维持其最基本的生命活动:
(1)HBsAg,特别是 L-HBsAg 的表达减少,阻碍了新组装的核衣壳及时转运至多泡体(MVBs)以获取囊泡膜。在这种状态下,没有囊泡膜的裸露核衣壳允许脱氧核苷三磷酸(dNTPs)长时间自由进入,从而增强了正链 DNA 的合成;
(2)具有延长正链的成熟病毒颗粒由于刚性和负电荷增加,在磷酸化修饰及衣壳解组装方面显示出优势,从而促进成熟的 HBV 衣壳通过核孔复合物选择性转运进入细胞核,并释放 rcDNA 以维持 cccDNA 池的水平。
总体而言,在宿主免疫压力下,慢乙肝疾病进展中积累的 BCP 突变及 BCP/PC 复合突变,会导致 pgRNA 转录活性选择性增强、核心蛋白表达量增加以及 HBsAg 表达水平下降。此外,SP1/SP2 基因突变与表观遗传修饰会抑制启动子活性,导致 L-HBsAg 和 HBsAg 缺失。
这种机制反过来促进了 cccDNA 的细胞内再合成,使得病毒即便在宿主免疫压力下,仍能在低病毒载量条件下维持慢性感染。
想深入了解具体机制?请随肝霖君一起层层揭秘吧!
研究方法
研究纳入两个经基于 PEG IFNα的治疗获得 HBsAg 清除的慢乙肝患者临床队列,并利用公共数据集和分子生物学实验进行全面分析。
队列 A:1658 名在北京佑安医院接受抗病毒治疗并获得 HBsAg 清除的患者。
队列 B:58 名在复旦大学附属华山医院接受抗病毒治疗并获得 HBsAg 清除的患者。
研究结果
01
慢乙肝患者经基于 PEG IFNα治疗获得 HBsAg 清除时,约 20% 患者的 HBeAg 和/或 HBV DNA 仍为阳性
队列 A:
在血清 HBsAg 首次检测不到时,20.9%(347/1658)的患者血清 HBeAg 和/或 HBV DNA 检测结果仍为阳性。其中,7.2%(120/1658)仅 HBeAg 阳性,12.4%(206/1658)仅 HBV DNA 阳性,1.3%(21/1658)两者均阳性。这部分患者在 36.3 ± 11.0 岁时实现 HBsAg 清除;ALT 和 AST 分别为 39.3(24.0 - 69.5)U/L 和 34.6(25.5 - 55.0)U/L;分别有 46.4%(161 名)和 56.2%(195 名)的患者实现 HBsAb 和 HBeAb 转阳。
进一步分析显示,与仅 HBV DNA 阳性组及 HBV DNA 和 HBeAg 均阴性组相比,仅 HBeAg 阳性组的 HBeAb 阳性率显著较低(P < 0.001)。仅 HBeAg 阳性组的 HBsAg 血清学转换率高于仅 HBV DNA 阳性或两者均阳性的患者(P = 0.005)。
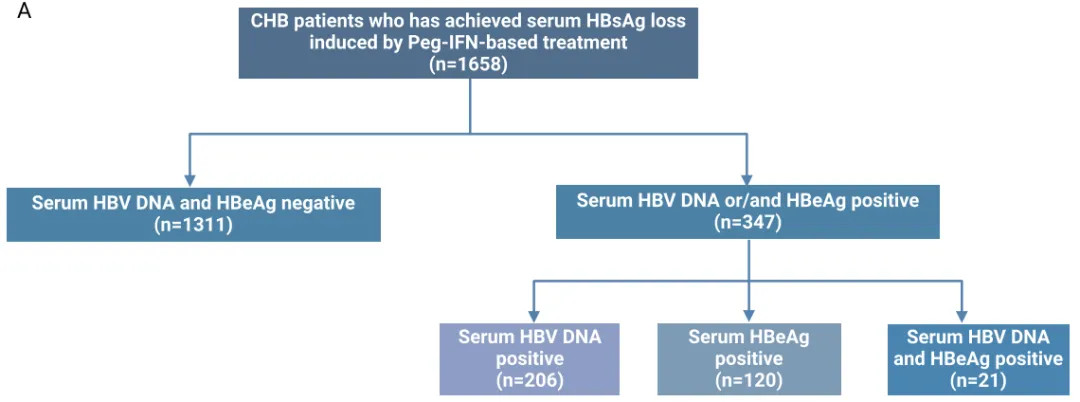
表 1. 队列 A 中获得 HBsAg 清除但 HBeAg 和/或
HBV DNA 仍阳性患者的人口统计学特征
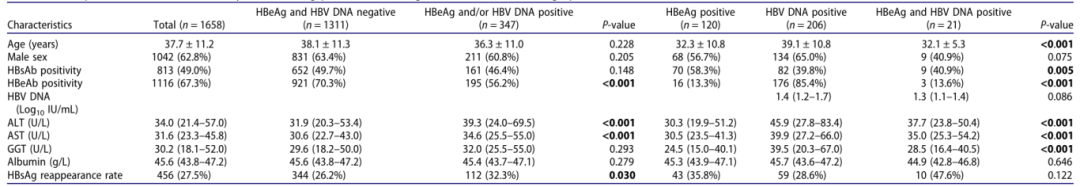
队列 B:
17.2%(10/58)的患者在获得 HBsAg 清除时 HBeAg 仍为阳性。其中的 4 名患者中,3 名接受 PEG IFNα巩固治疗实现 HBeAg 清除,在停药后 48 周内均未出现 HBsAg 复阳;而 1 名未获得 HBeAg 清除的患者出现 HBsAg 复阳。在所有病毒学标志物均转阴的患者中,14.6%(7/48)出现 HBsAg 复阳。
回归分析显示,停药时血清 HBeAg 阳性、ALT 和 AST 水平是停药后 HBsAg 复阳的独立预测因素。
02
表观遗传修饰和基因突变导致 cccDNA 中 SP1/SP2 启动子的转录活性下调或缺失
HBV 基因组是 Dane 颗粒中高度紧凑的 3.2 kb 部分双链松弛环状 DNA(rcDNA),包含四个重叠的开放阅读框(ORF)、启动子、增强子以及其他高效复制所需的关键元件。病毒感染后,rcDNA 进入细胞核并被修复成共价闭合环状 DNA(cccDNA),作为五种病毒 mRNA 的转录模板(图 3A)。
在 Huh-7 细胞中使用 prcccDNA/Cre cccDNA 模拟系统进行长读 RNA 测序分析,结果表明,cccDNA 中 SP1/SP2 启动子(驱动 HBsAg 产生)的转录活性显著强于 PC/BCP 启动子(驱动 HBeAg 产生),且在 3 名 HBeAg 阳性患者肝活检组织样本的测序数据中证实。前述临床现象与此实验室数据似乎矛盾,因为源自 cccDNA 的 pgRNA/PreC RNA 产物在 HBsAg 清除后不应再被检测到。
为了探究上述「异常」临床现象发生的潜在原因,首先考虑其中部分个体可能感染了病毒变异株,产生抗原修饰的 HBV S 蛋白,无法被现有的 HBsAg 检测方法检测到。然而,这种罕见的 HBsAg 免疫逃逸突变位点,以及针对 HBsAg 多个表位日益灵敏的商业化 HBsAg 检测方法,均无法解释该临床现象近 20% 的发生率。
因此推测:是否由于表观遗传修饰或基因突变机制导致 cccDNA 中 SP1/SP2 启动子的转录活性下调或缺失?
利用数据库中慢乙肝患者的 ChIP-seq 数据发现,随着疾病进展,SP1/SP2 启动子区域的抑制性组蛋白修饰(H3K9me3)显著增加,而激活性组蛋白修饰(H3K4me3)则明显减少(图 3B)。这种同步性变化表明,虽然 SP1/SP2 启动子区域经历选择性转录沉默,但 PC/BCP 区域可能仍保留部分转录活性,使得 HBV 能够以低水平但仍可检测到的方式持续进行转录和复制。
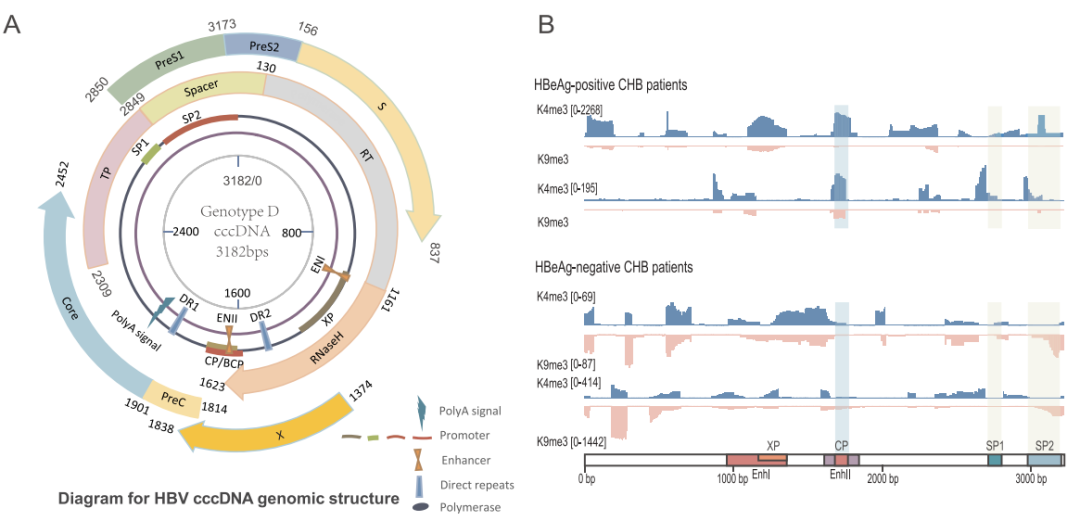
03
SP1/SP2 突变通过减轻转录干扰来增强邻近 PC/BCP 的转录活性
通过检索数据库分析慢乙肝自然史中 PreS/S ORF 和 SP1/SP2 启动子区域内的框内突变。该数据集包含 81 名慢乙肝患者,其中免疫耐受期(IT)27 名、免疫活动期(IA)15 名、免疫控制期(IC)23 名及 HBeAg 阴性慢乙肝(ENEG)16 名。最终纳入 65 个样本。
考虑到在高度紧凑的 cccDNA 中,PreS/S ORF 和 SP1/SP2 启动子完全嵌入在 Pol 蛋白的 ORF 内,PreS/S ORF 和 SP1/SP2 启动子的突变潜力应受到限制,以防止 Pol 蛋白功能的丧失。在慢乙肝的整个自然史中,SP1、preS/S 编码区及 PC/BCP 区域都存在与 Pol 蛋白相对的框内突变(图 4A)。此外,在宿主抗病毒免疫压力下,IA 和 ENEG 阶段 SP1 和 preS/S 编码区的缺失突变率显著高于 IT 和 IC 阶段,且比率不受不同阶段 HBV 复制能力差异的影响(图 4B)。
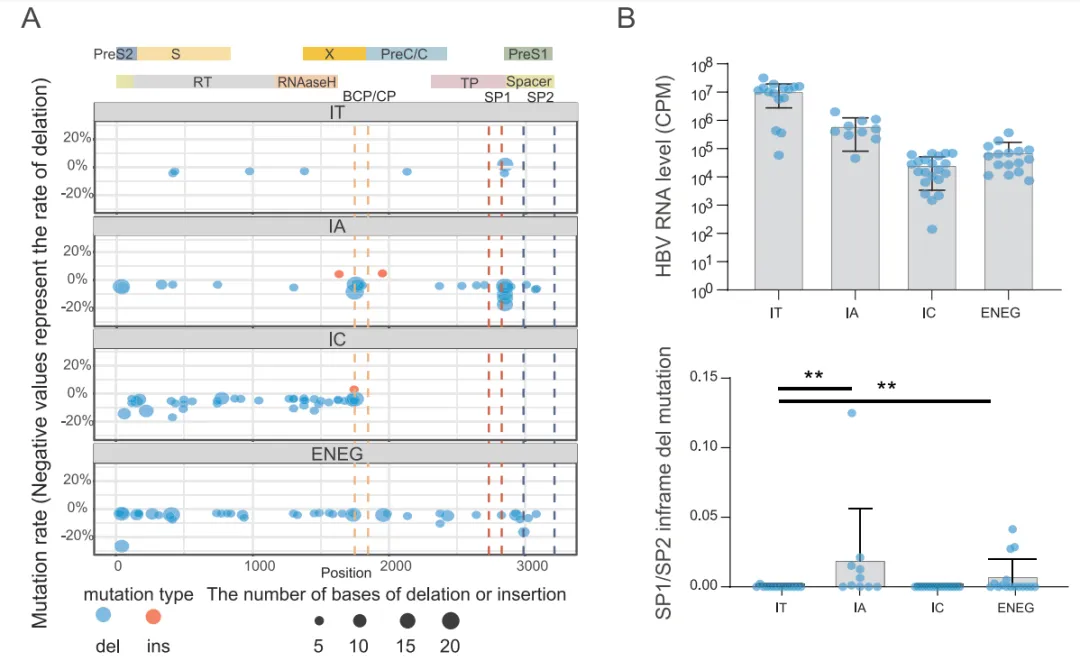
推测这些 SP1/SP2 启动子的框内突变可能减轻了其对邻近 PC/BCP 启动子转录活性的抑制作用,因为 cccDNA 上各种启动子转录活性之间的相互干扰最终可能都会增强 HBV DNA 的复制。
在 SP 启动子的核心功能区引入点突变,构建含有 SP1、SP2 及双突变体的 prcccDNA 质粒,以研究其对 PC/BCP 转录活性的影响。结果表明 SP1 突变降低了 L-HBs 蛋白的表达,而 SP2 突变降低了 S-HBs 蛋白的水平。在双突变情况下,L 和 S-HBs 蛋白水平均降低,并且含有 SP2 和 SP1/SP2 双突变体的上清液中 HBsAg 水平显著降低。由于 SP1 突变导致 L-HBs 减少,从而提高了 HBsAg 的分泌效率,导致上清液中 M-和 S-HBsAg 水平显著增加(图 5A、B)。
将野生型和突变体质粒瞬时转染到 HepG2 细胞中。结果显示,相比于野生型,SP2 和 SP1/2 突变显著上调了 3.5 kb HBV RNA 和核心蛋白的水平,证明了 PreS1/S2 启动子对 PC/BCP 施加的转录干扰(图 5A、D)。此外,与野生型相比,SP2 突变体中血清 HBeAg 水平显著增加(图 5C)。SP2 突变对 3.5 kb HBV RNA 和核心蛋白水平的上调作用显著强于 SP1 突变,可能是由于 SP2 启动子的转录活性远高于 SP1。
为了确定 HBsAg 是否可以减弱对 PC/BCP 启动子的转录干扰,在 prcccDNA/pCMV-cre 的 HBsAg 起始密码子「ATG」处引入突变,使 HBsAg 无法翻译。这种修饰对上清液中的 HBeAg 和 HBV DNA 水平以及细胞内核心蛋白的表达均无显著影响(图 5E - I)。
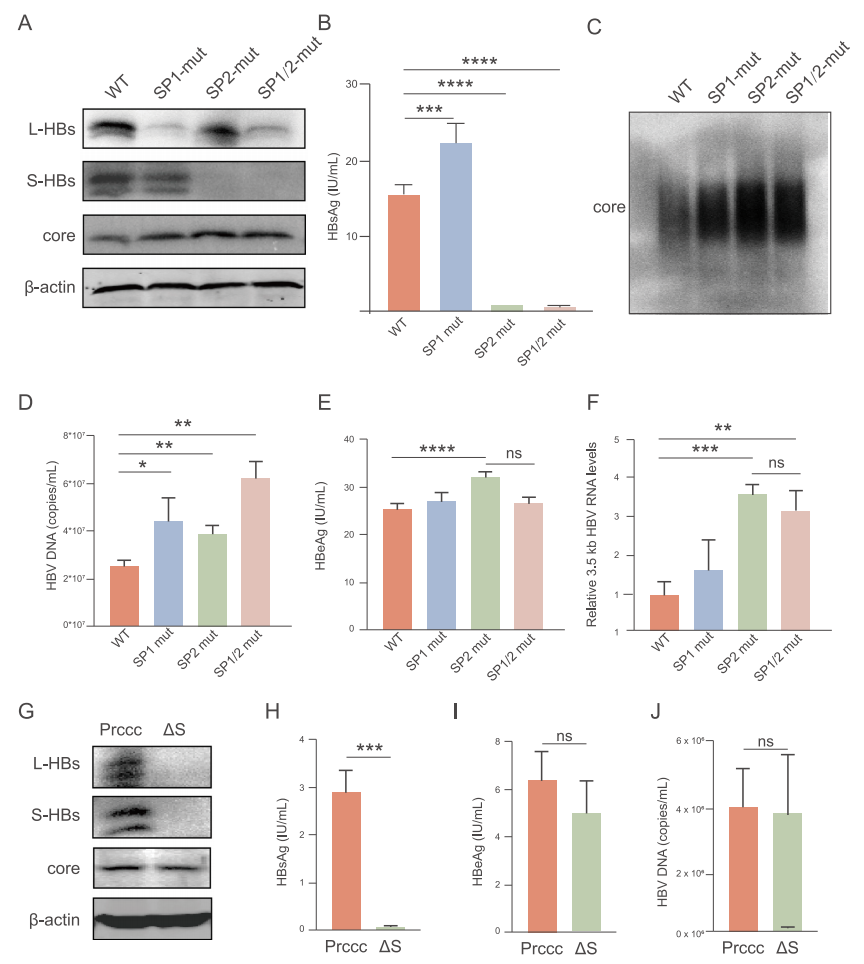
ChIP-qPCR 结果显示 SP1、SP2 和双突变降低了 BCP 区域的 H3K4me3 和 H3K9me3。这种转录信号的下调与数据库分析结果一致,表明这些信号随着病毒载量从高到低的转变而下调,然而,BCP 区域保留了足够的转录活性来维持慢性感染。
04
L-HBs 和包膜蛋白的缺乏导致细胞内 cccDNA 累积,促进慢性感染的维持
为了进一步阐明 HBsAg 缺乏对 HBV 复制的影响,构建了缺乏 L-HBsAg 和包膜蛋白(所有 HBsAg 蛋白)表达的突变质粒(pCMV-HBV-ΔL、pCMV-HBV-ΔEnv;图 6A、B)。上述突变导致 HBV 复制中间体(rcDNA、dslDNA、ssDNA)水平增加,并促进细胞内 cccDNA 的累积(图 6C)。虽然上清液中总 HBsAg 在 L-HBsAg 缺乏时增加,但 HBeAg 并未随着 L-HBsAg 和包膜蛋白缺乏时 cccDNA 的增加而增加。
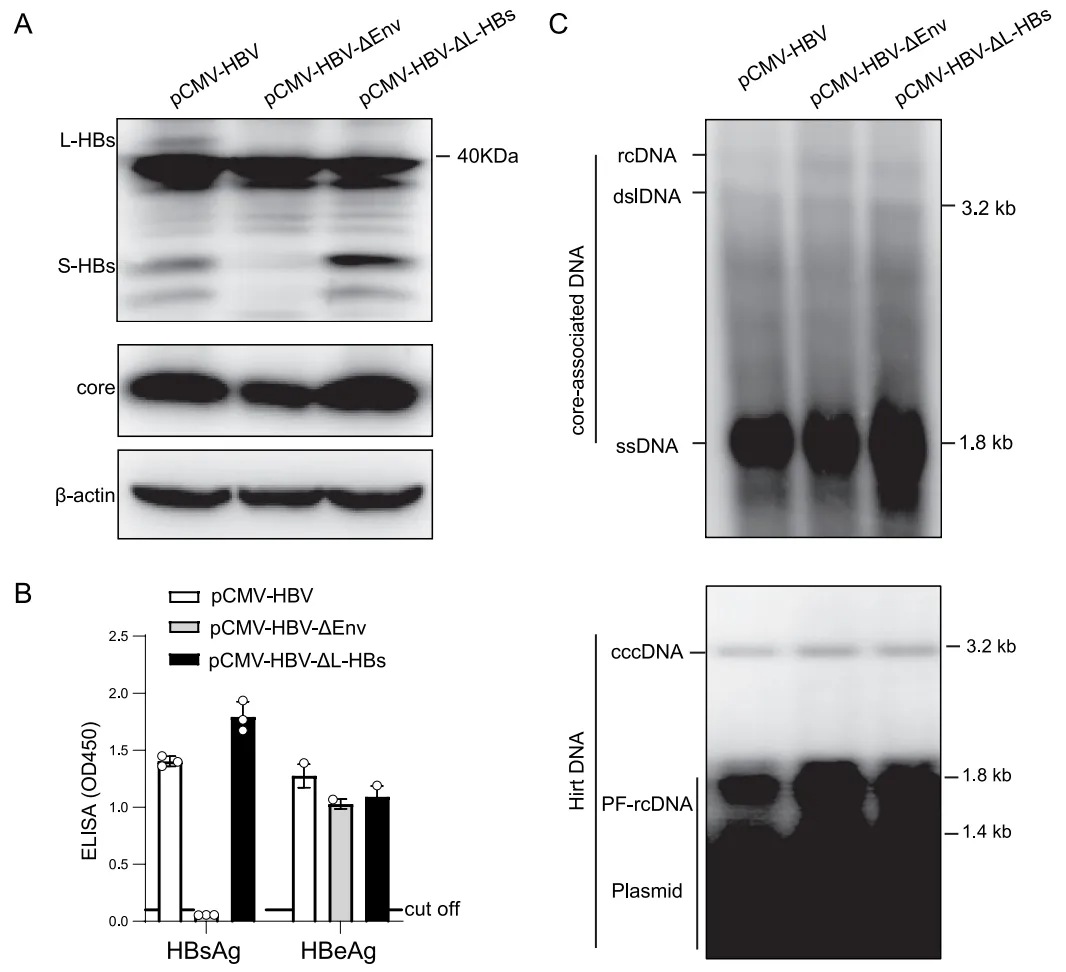
研究构建了一个依赖 cccDNA、带有 HA 标签的 HBeAg 表达系统,该系统可以消除来自 HBcAg 的混杂信号,以探究 HBsAg 缺乏对 cccDNA 积累的影响(图 7A)。在该系统中引入 HBsAg 和 L-HBsAg 表达缺失的突变。将两种突变质粒转染入 Huh-7 细胞后,均使上清液中 HA-HBeAg 的水平升高(图 7D),表明细胞内 cccDNA 含量增加。
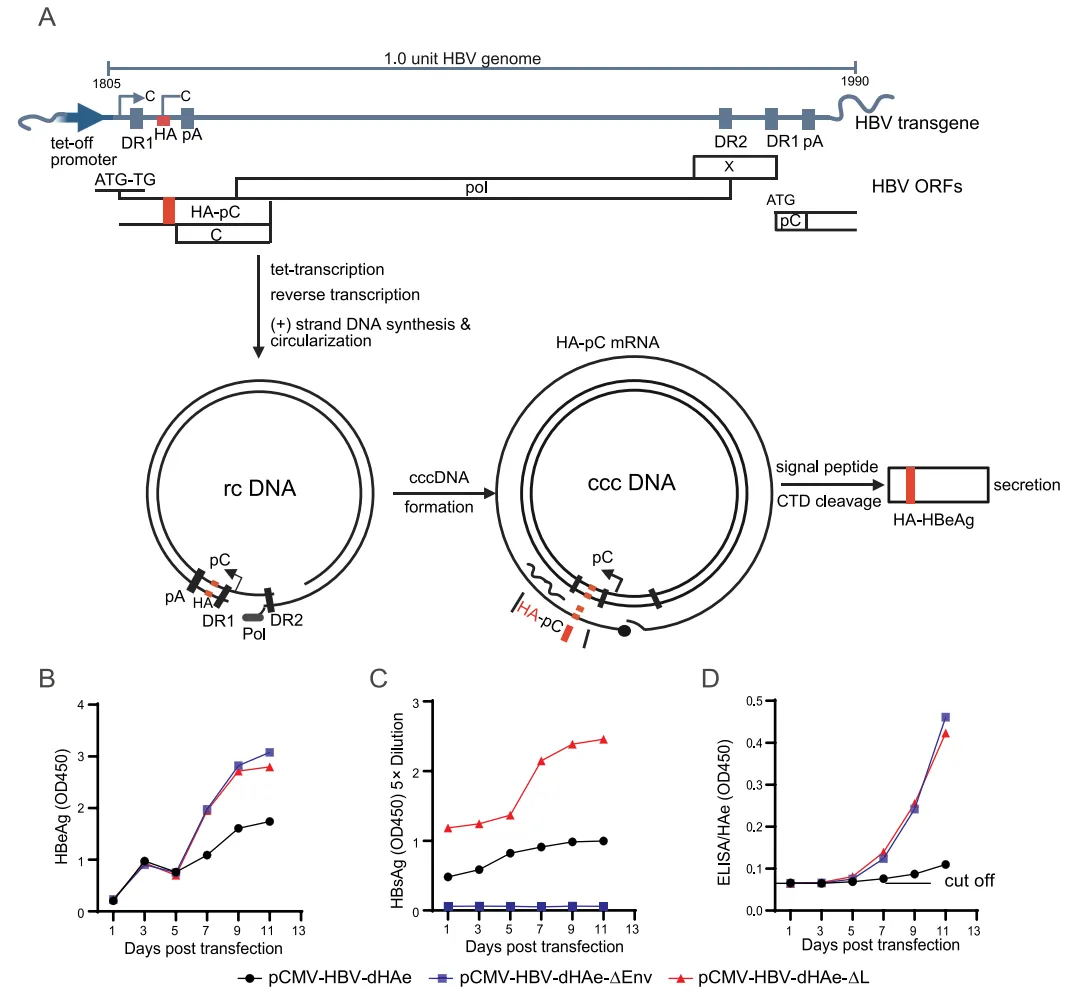
上清液中 HA-HBeAg 的水平
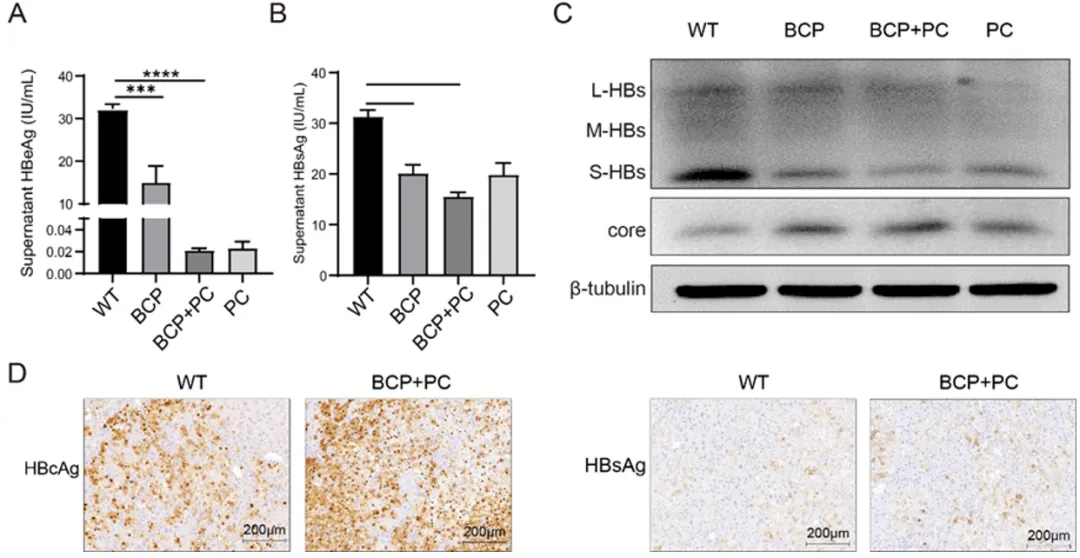
前期实验还发现,在慢乙肝自然史中频繁发生的 BCP 突变(A1762T/G1764A)及 BCP/PC 联合突变(G1896A)会选择性地导致 pgRNA 转录上调和 HBsAg 表达下调,有利于宿主免疫压力下慢性 HBV 感染的维持。
在本研究中,使用 HBV 循环系统探究 BCP 突变和 BCP/PC 联合突变对 HBV 复制的影响。结果显示,由于 BCP 突变和 BCP/PC 联合突变,细胞上清液中 HBeAg 和 HBsAg 显著降低(图 8A、B)。Western blot 结果显示细胞内 HBsAg 表达减少,特别是 S-HBsAg,同时核心蛋白表达增加(图 8C)。在人源化小鼠肝模型中的免疫组化结果也证实,BCP/PC 联合突变导致肝脏中核心蛋白表达增加和 HBsAg 减少(图 8D)。
肝霖君有话说
理论上,HBsAg 清除意味着整合 HBV DNA 及肝内 cccDNA 的消除或转录沉默,但在大样本队列中观察到,约 20% 的慢乙肝患者在经基于 PEG IFNα的治疗获得 HBsAg 清除后,血清 HBeAg 和/或 HBV DNA 仍为阳性,表明 cccDNA 的 PC/BCP 启动子仍保留一定的转录活性。关于这种临床现象,文章提出三种可能的原因:
(1)部分慢乙肝患者可能感染了病毒变异株,产生抗原修饰的 HBV s 蛋白,无法被现有的 HBsAg 检测方法检测到;
(2)表观遗传组蛋白修饰或基因突变机制可能导致 cccDNA 中 SP1/SP2 启动子的选择性转录活性下调或缺失;
(3)SP1/SP2 启动子的突变可能降低其活性,导致在 HBeAg 和 HBV DNA 转阴前就出现了 HBsAg 清除。
对于这部分患者,在获得 HBsAg 清除时即停止治疗可能存在 HBsAg 复阳的风险。因此,应在实现所有病毒学标志物转阴后再考虑停药,以提高 HBsAg 清除的持久性。
参考文献:
Jiang B, Guan G, Zhao K, et al. Mechanisms underlying delayed loss of HBeAg and HBV DNA following HBsAg seroclearance in PEG-IFNα treated patients of chronic hepatitis B[J]. Emerg Microbes Infect, 2025, 14(1): 2475847.
好文章,需要你的鼓励
















