来源:《临床儿科杂志》
王真, 朱嘉莳, 付盼, 王丹, 张娜, 邵静波, 李红. 复发急性淋巴细胞白血病患儿的预后及影响因素单中心分析 [J]. 临床儿科杂志, 2025, 43(4): 271-277 DOI:10.12372/jcp.2025.24e0563
WANG Zhen, ZHU Jiashi, FU Pan, WANG Dan, ZHANG Na, SHAO Jingbo, LI Hong. Single center analysis of prognosis and influencing factors in relapsed pediatric acute lymphoblastic leukemia[J]. Journal of Clinical Pediatrics, 2025, 43(4): 271-277 DOI:10.12372/jcp.2025.24e0563
本文作者:王 真 朱嘉莳 付 盼 王 丹 张 娜 邵静波 李 红
作者单位:上海交通大学医学院附属儿童医院血液肿瘤科(上海 200040)
摘要:目的 探讨急性淋巴细胞白血病(ALL)复发患儿的临床特征及分析影响预后的因素。方法 选取 2006 年 2 月至 2019 年 12 月接受国内儿童急性淋巴细胞白血病协作组方案治疗的 458 例初诊 ALL 儿童,回顾性分析 76 例复发 ALL 儿童的临床特征及影响预后因素。结果 本中心儿童 ALL 总体复发率为 16.6%(76/458);复发 ALL 患儿死亡率 57.9%(44/76),复发 ALL 患儿 5 年总体生存率为(38.6±5.9)%。按复发时间分组,极早期复发 26 例、早期复发 30 例、晚期复发 20 例,三组 5 年总体总生存率(OS)差异有统计学意义(P<0.001)。按复发部位分组,单纯骨髓复发 57 例,髓外复发 12 例及髓内外联合复发 7 例,三组 5 年 OS 率差异有统计学意义(P<0.05)。76 例复发儿童 11 例放弃治疗,65 例接受再次治疗,未获得 2 次完全缓解(CR2)14 例,获 CR2 51 例,两组 5 年 OS 率差异有统计学意义(P<0.001)。按照复发后治疗方式分组分为异基因造血干细胞移植组(Allo-HSCT)22 例(33.8%),嵌合抗原受体 T 细胞疗法(CART)治疗组 8 例(12.3%),CART 联合 Allo-HSCT 组 14 例(21.5%),单纯化疗和(或)靶向药物组 21 例(32.2%),组间比较 5 年 OS 率差异有统计学意义(P<0.001)。单因素预后分析显示初诊白细胞>100×109/L、初诊危险度、复发时间、复发部位、复发后危险度、复发后治疗方案、是否获得 CR2 是影响复发 ALL 儿童预后的独立危险因素(P<0.05)。Cox 回归模型进行多因素预后分析,极早期复发和复发后未获得 CR2 是影响复发 ALL 患儿预后的独立危险因素(P<0.05),复发后接受 CART 细胞衔接移植治疗是复发 ALL 患儿预后保护因素。结论 本中心儿童 ALL 复发时间以早期复发为主,复发部位以骨髓复发为主。多因素预后分析极早期复发和复发后未获得 CR2 是复发 ALL 患儿预后的独立危险因素(P<0.05)。CART 联合 Allo-HSCT 可改善复发急淋患儿预后。
关键词:儿童;复发急性淋巴细胞白血病;预后;嵌合抗原受体 T 细胞疗法;异基因造血干细胞移植
儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是儿童最常见的恶性肿瘤,占儿童 ALL 的 80% 以上,占儿童癌症的 25%[1]。随着多智能体化疗策略的使用,儿童 ALL 患者的长期临床结果得到了显著改善,5 年总生存率(OS)超过 90%,但研究报道儿童 ALL 复发率为 10%~40%,这仍然是治疗失败的最常见原因 [2-3],复发 ALL 患者的预后较差,在高收入国家的长期生存率为 58%~72%,在欠发达国家,长期生存率仅为 27%~42%[2-4]。复发 ALL 的治疗仍然是一个挑战。在过去,治疗复发 ALL 的选择是更高强度的化疗或异基因造血干细胞移植,高强度化疗易导致严重感染、难以维持二次缓解至移植等增加复发 ALL 死亡率,现在 CART 细胞治疗复发 ALL 患儿的疗效显著优于传统化疗。研究分析本中心复发 ALL 患儿的预后危险因素及复发后不同的治疗方式的长期生存情况。
1 对象与方法
1.1 研究对象
回顾性分析 2006 年 2 月至 2019 年 12 月在上海儿童医院接受国内儿童急性淋巴细胞白血病协作组方案 SCMC-ALL-2005 方案 [5]、CCCG-ALL-2015 方案 [6] 治疗的 458 例初诊 ALL 儿童,随访至 2022 年 12 月 31 日,共计纳入复发患儿 76 例。
1.2 方法
1.2.1 化疗方案 CCCG-ALL-2015 方案与 SCMC-ALL-2005 方案差异为:①窗口期。ALL-2015 方案用地塞米松(Dex)6 mg/(m2·d)×4d 代替 ALL-2005 方案的醋酸泼尼松(Pred)40 mg/(m2·d)×7d;在诱导治疗期的第 8~29 天泼尼松由 40 mg/(m2·d)加量至 45 mg/(m2·d)。②ALL-2015 方案用培门冬酶代替普通门冬酰胺酶;ALL-2005 方案中/高危组普通门冬酰胺酶用量 6000μ/m2 2 个循环共 16 次;2015 方案中/高危组培门冬酶 2000μ/m2 共 7 次。③巩固治疗 HDMTX。ALL-2005 方案低危组 3 g/m2×4 次、中高危组 5 g/m2×5 次;ALL-2015 方案低危组 3 g/m2、中高危组 5 g/m2 均×3 次。④ALL-2015 方案 BCR/ABL 融合基因阳性患者随机分组应用靶向药物酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)达沙替尼或伊马替尼。
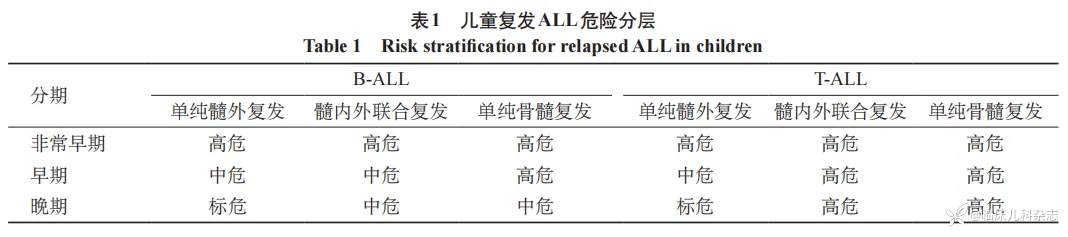
1.2.2 复发定义及分层 骨髓复发定义为骨髓形态学检查幼稚细胞 ≥ 20%;中枢复发定义为脑脊液甩片形态学检查幼稚细胞 ≥ 5×106/L;睾丸复发定义为病理检查证实的单纯睾丸复发,或体检或 B 超确认的睾丸合并骨髓复发。按复发时间 [7] 分非常早期复发,早期复发及晚期复发,非常早期复发定义为诊断后 18 个月内复发;早期定义为在 18 个月或以后但<36 个月的诊断内的复发;晚期定义为诊断后 36 个月或以后的复发。复发部位分单纯骨髓复发、单纯髓外复发(中枢复发和/或睾丸复发)、髓内外联合复发(骨髓+髓外复发)。
中国儿童肿瘤协作组急性淋巴细胞白血病复发方案(Chinese Children’s Cancer Group,CCCG Relapsed ALL)将复发-ALL 基于复发的时间和复发的部位进行危险分层 [8](表 1)。
1.2.3 治疗方式 患者复发后接受化疗、靶向药物酪氨酸激酶抑制剂(TKI)、嵌合抗原受体 T 细胞疗法(chimeric antigen receptor T-cell immunotherapy,CART)、异基因造血干细胞移植组(allogenetic hematopoietic stem cell transplantation,Allo-HSCT)等治疗。本组 22 例复发 B-ALL 患儿接受自体 CD19 或 CD22 CART 细胞治疗 24 例次,流式细胞术检测白血病细胞为 CD19 dim 或 CD19 不表达以及既往 CD19-CART 治疗无效的患者选择 CD22-CART,其余患者选择 CD19-CART。T-ALL 均未行 CART 细胞治疗。6 例 BCR/ABL 融合基因阳性骨髓复发患儿均接受靶向药物络氨酸激酶抑制剂(TKI)治疗;36 例患儿行 Allo-HSCT 38 例次,其中脐血移植 1 例次(2.6%),亲缘单倍体基因移植 17 例次(44.7%),非亲缘单倍体移植 20 例次(54.0%),Allo-HSCT 前均为分子学缓解状态 [骨髓微小残留病(minimal residual disease,MRD)<0.01%]。本研究中均未行放疗治疗。
1.2.4 缓解标准 骨髓复发二次缓解定义为复发 ALL 患儿经过再次诱导缓解治疗后骨髓形态学检查幼稚细胞 5%;中枢神经系统复发缓解标准定义为脑脊液幼稚细胞清除,睾丸复发缓解标准定义为肿大睾丸较前回缩,影像学检查未提示异常血流及回声。
1.2.5 随访 复发后 OS 为首次复发时间开始至至死亡或随访结束,新事件包括二次复发和任何原因的死亡;根据治疗方案(如化疗、CART 细胞治疗或 Allo-HSCT)不同,定期评估骨髓细胞学、MRD、血常规、肝肾功能、腹部超声等;以住院、门诊及电话回访。
1.3 统计学分析
应用 SPSS 21.0 软件进行统计学分析,计数资料样本数及百分比表示,采用 Kaplan-Meier 法进行生存率的分析并绘制生存曲线,组间生存率的比较采用 Log-rank 检验,单因素分析 P<0.05 的因素纳入 Cox 回归模型进行多因素分析确定独立预后因素。P<0.05 认为差异具有统计学意义。
2 结果
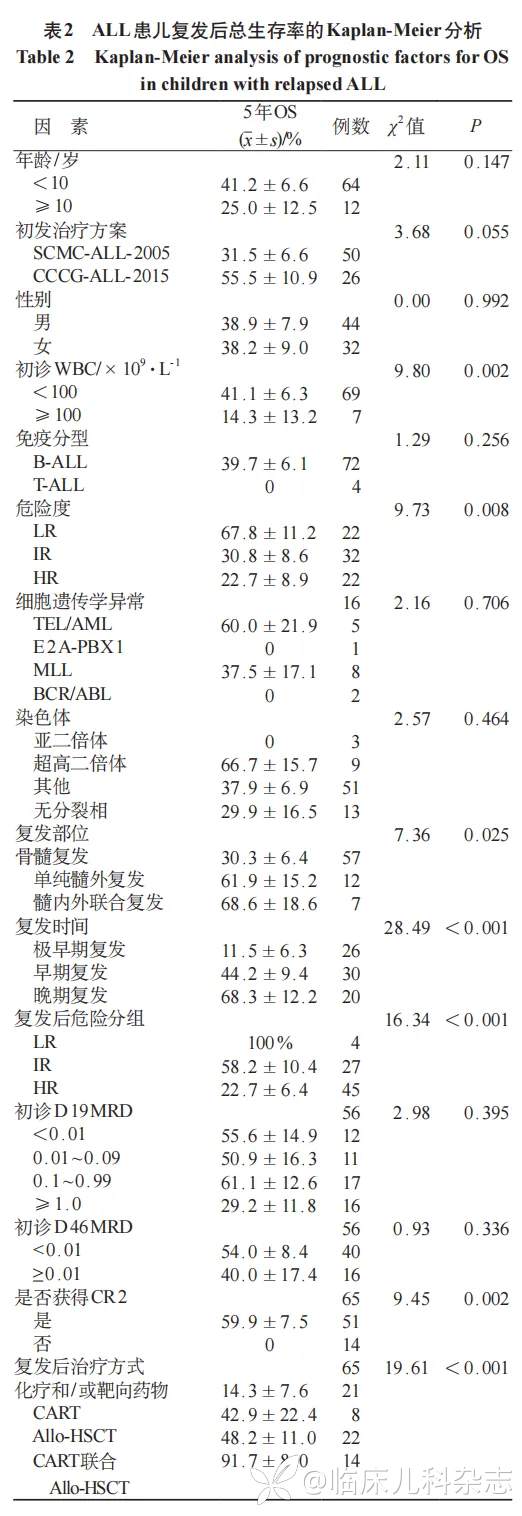
2.1 复发患儿临床特征
共纳入 76 例复发 ALL 患儿,按复发时间分组,极早期复发组、早期复发组、晚期复发组 5 年总体总生存率(OS)差异有统计学意义(P< 0.001),复发中位时间 28(1~95)个月,中位随访时间 9(1~155)个月 ;按复发部位分组,单纯骨髓复发组,髓外复发组及髓内外联合复发组 5 年 OS 率有统计学差异(P<0.05);初诊有 MRD 标记者 56 例,其中 D19MRD 和 D46MRD 的 <0.01、0.01~0.09、0.1~0.9、≥ 1.0 组差异无统计学意义(P>0.05)。见表 2。
2.2 不同治疗方式生存情况比较
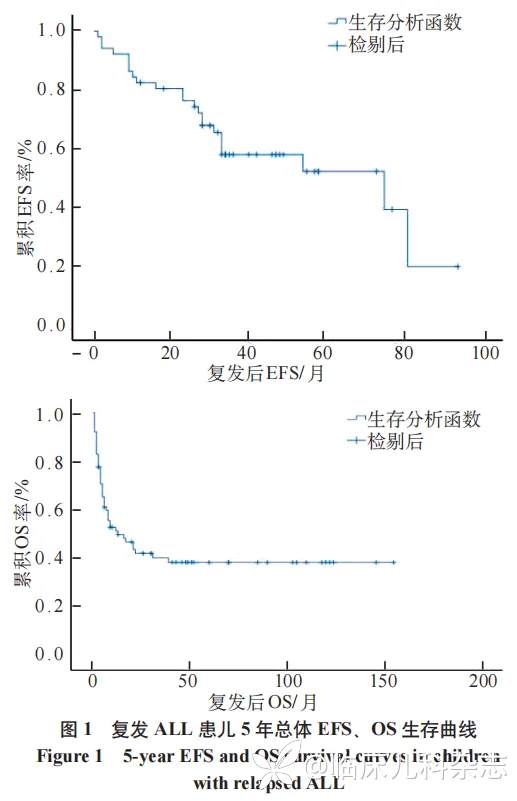
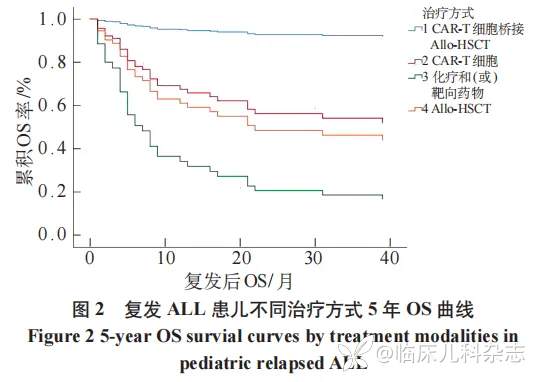
76 例首次复发 ALL 儿童,其中首次复发后放弃治疗患儿 11 例,5 年总体 EFS 率(19.5±15.3)%,5 年总体 OS 率(38.6±5.9)%(图 1)。本研究中 6 例 BCR/ABL 融合基因阳性骨髓复发患儿 TKI(达沙替尼 5 例、博纳替尼 1 例)治疗,3 例未行 HSCT 者纳入化疗和/或靶向药物治疗组,3 例接受 HSCT 治疗者纳入 Allo-HSCT 组。治疗方式分组分为化疗和/或靶向药物治疗组 21 例(32.2%)、单纯 CART 治疗组 8 例(12.3%),Allo-HSCT 组 22 例(33.8%)、CART 细胞联合 Allo-HSCT 组 14 例(21.5%),5 年 OS 率分别为 14.3%±7.6%、42.9%±22.4%、48.2%±11.0%、91.7%±8.0%,差异有统计学意义(P<0.001),见图 2。复发后单纯 CART 组治疗共 8 例,其中睾丸复发 2 例、中枢复发 2 例均持续缓解状态;骨髓复发 4 例,其中 2 例 2 次骨髓复发后疾病进展死亡,1 例因细胞因子风暴(CRS)死亡,1 例存活。Allo-HSCT 组 22 例,移植相关死亡 4 例(18.1%)、移植后 2 次复发 6 例(27.2%),其中 5 例放弃死亡、1 例接受 2 次移植后感染死亡,余 12 例(54.5%)均长期生存。CART 联合 Allo-HSCT 治疗共 14 例,其中 CART 后 CR2 桥接 Allo-HSCT 10 例,其中 1 例 2 次复发后行第 2 次 CART 获得持续 CR;其他 4 例为首次 Allo-HSCT 2 次复发患儿,其中 1 例 CART+2 次 Allo-HSCT 达持续缓解状态;其中 3 例再次接受单纯 CART 治疗,再复发死亡 1 例,2 例持续 CR。
2.3 复发后总生存情况分析
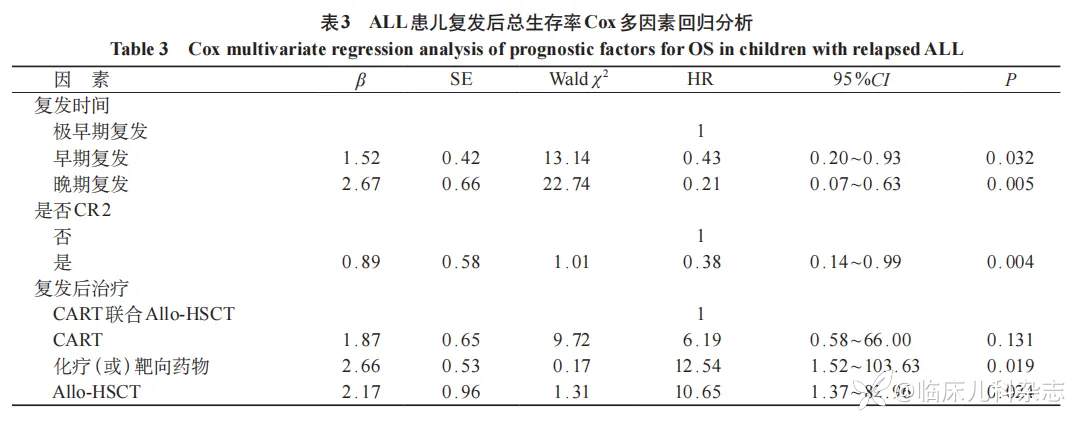
影响复发后 OS 的可疑因素的单因素分析结果见表 2。年龄、性别、初发治疗方案、初发免疫分型、常见融合基因异常、染色体数目异常,初诊 D19MRD、初诊 D46MRD 因素组间比较均无统计学差异(P 均>0.05);初诊白细胞(WBC)100×109/L、初诊高危组、极早期复发、骨髓复发及复发后高危组,复发后未获得 CR2,复发后单纯化疗治疗方式均为影响 OS 的危险因素(P 均<0.05)。将单因素分析中的危险因素纳入 Cox 多因素回归分析中,可以看出,极早期复发、未获得 CR2、化疗为影响复发 ALL 儿童 OS 的独立危险因素,CART 细胞联合 Allo-HSCT 为预后保护因素。见表 3。
2.4 死亡原因
76 例复发 ALL 患儿中,死亡 44 例(59.2%),其中首次复发后放弃 11 例 ;65 例复发患儿再治疗,其中未获 CR2 患儿 14/65 例(21.5%)无一例存活,其中 2 例为 CART 治疗后再次骨髓复发后放弃、1 例 CART 治疗后炎症因子风暴后死亡、11 例为化疗后疾病进展死亡 ;CR2 患儿 51 例中移植相关死亡 4 例(7.8%)、化疗相关死亡 3 例(5.8%)、2 次复发后放弃 12 例(23.5%)。2 次复发患儿 15 例,其中首次复发移植后 2 次复发 10 例,首次复发化疗后 2 次复发 4 例、首次复发 CART 桥接 Allo-HSCT 复发 1 例;除放弃 12 例外,余 3 例均存活,其中 CART 桥接 2 次 Allo-HSCT 后存活 2 例、2 次 CART 后存活 1 例。
3 讨论
B-ALL 占所有儿童 ALL 的 80% 以上 [1],随着对于发病机制的深入研究、危险基因识别精准分层、化疗及靶向药物的应用显著改善 ALL 患儿的预后,但约 15%~20% 的患者有 B-ALL 复发,复发患儿预后仍差。本研究 ALL 患儿总体复发率为 16.6%,5 年 OS 率为(38.6±5.9)%,同高收入发达国家的长期生存率 58%~72% 相比偏低,与其他欠发达国家的长期生存率 27%~42% 持平 [2-4]。
多项研究报道,早期和极早期复发、T-ALL、年龄 ≥ 10 岁、骨髓复发、低二倍体均是复发 ALL 患儿的独立预后危险因素 [3-4,9-11]。北美儿童血液肿瘤学学会(North American Society of Pediatric Hematology/Oncology,NOPHO)研究报道 1992 年 1 月至 2018 年 12 月间 608 例复发 ALL 中,对于极早期复发的患者,4 年 OS 仅为 23.2%(95%CI:16.5%~30.5%),与 ALL 诊断后 36 个月以上的晚期复发相比,风险比为 6.26(95%CI:4.57~8.56);本研究中极早期复发患儿 5 年 OS 仅为(11.5±6.3)%,与早期复发、晚期复发患儿相比,风险比分别为 0.43(95% CI:0.20~0.93,P= 0.032)、0.21(95%CI:0.07~0.63,P= 0.005)。尽管文献中已经报道了免疫表型与复发 ALL 预后相关,但研究结果并不一致,其他研究报道复发的 B-ALL 与更好的生存率有关 [12],最近的研究报告称,复发性 B 细胞和 T 细胞 ALL 患者的生存率没有显著差异 [4,10],正如在本研究中发现的那样,免疫表型与复发后生存率无关。研究报道复发重新诱导后未达到 CR2 的患者生存率非常低 [13],本研究中未达到 CR2 的患儿无一例存活,Cox 多因素分析中,与达到 CR2 相比,风险系数为 0.38(95%CI:0.14~0.99,P= 0.049)。年龄 ≥ 10 岁是 ALL 患儿复发后生存率低下的重要预测因素 [14],年龄是否大于 10 岁对于预后的影响无统计学差异,同 Abdelmabood 等 [9] 的研究结果一致。本研究中单因素分析提示骨髓复发 5 年 OS 率(30.3±6.4)%,较单纯髓外复发或髓内外联合复发预后差(P= 0.025),复发后的危险分层中,高危组 5 年 OS 率(22.7±6.4)%,同低危组、高危组比较预后差(P<0.001)。然而在多因素回归分析中,并非独立危险因素。其他危险因素如亚二倍体、MLL 重排预后危险单因素分析中较其他遗传学异常无统计学差异,分析可能与病例数少相关。
在过去,治疗复发 ALL 的唯一选择是更高强度的化疗或造血干细胞移植。强化化疗的缺点是复发 ALL 感染率高,死亡率高。此外,强化化疗方案可达到 60% 的 CR2 率,但只有 48% 的患儿维持持续缓解状态并接受移植,仍有患儿不能缓解持续足够长的时间,无法过渡到 HSCT[15-16]。提高复发难治(relapsing/refractory,R/R)ALL 预后的关键在于达到二次 CR 及 MRD 阴性后桥接 Allo-HSCT。随着 CD19 定向 CART 细胞治疗的出现,70%~90% 的 R/R-B-ALL 患者现在可以获得 CR2,但这些缓解的持久性仍是亟待解决的关键问题 [17],高达 50% 的患者在 CART 细胞治疗后的第一年内复发 [18]。CR2 后桥接 Allo-HSCT 可提高高危患者的总体生存率和无白血病生存率 [19];在美国国家癌症研究所(NCI)的儿科 CD19-CART 细胞试验中,28 例患儿通过流式细胞术获得最小残留疾病(MRD)阴性反应,21 例合并 HSCT 的患者中有 2 例复发,而 7 例未接受 CART 后 HSCT 的患儿中有 6 例复发 [20],本研究中,按照复发后治疗方式分组分为化疗和/或靶向药物治疗组 21 例(32.2%)、CD19-CART 治疗组 8 例(12.3%),Allo-HSCT 组 22 例(33.8%)、CART 细胞联合 Allo-HSCT 组 14 例(21.5%),5 年 OS 率分别为 14.3%±7.6%、42.9%±22.4%、48.2%±11.0%、91.7%±8.0%,存在统计学差异(P<0.001),在多因素分析中,与 CART 细胞联合 Allo-HSCT 相比,化疗和/或靶向药物的风险系数为 12.54(95%CI:1.52~103.63,P= 0.019),与 Allo-HSCT 相比,风险系数为 10.65(95%CI:1.37~82.96,P= 0.024),提示 CART 联合 Allo-HSCT 可显著改善复发 ALL 患儿预后,OS 率达 90% 以上。
本研究 ALL 复发患儿死亡率为 59.2%(44/76),分析原因可能是、前期患儿首次复发后放弃占比高,达 25.0%(11/44),10/11 例为 2017 年 9 月前复发患儿、1/11 例为 2022 年复发患儿;与复发后单纯化疗 2 次缓解率低有关,未获 CR2 的病人无存活,达 31.8%(14/44),与同期研究报道相符 [20]。综上,极早期复发、未获得 CR2 是 ALL 复发患儿的独立危险因素,随着 CART 及贝林妥欧等免疫治疗,复发 ALL 获得 CR 率明显提升,但 CART 细胞治疗后复发率高,故对于中高危组复发 B-ALL 患儿仍建议 CART 桥接 Allo-HSCT 治疗,可显著改善此部分复发 B-ALL 患儿预后;CART 序贯二次 Allo-HSCT 可使部分造血干细胞移植后复发 B-ALL 患者获得长生存。
好文章,需要你的鼓励
















