单形性亲上皮性肠道 T 细胞淋巴瘤(Monomorphic Epitheliotropic Intestinal T-Cell Lymphoma,MEIT)是一种原发性肠道 T 细胞淋巴瘤,因为病灶总发生在肠道,特别是小肠,曾经被认为是 II 型肠病相关 T 细胞淋巴瘤(EATL),由于这一类型淋巴瘤较为罕见,随着近年来的研究积累,对其的临床病理特征有了逐步清晰的认识,至世界卫生组织淋巴造血系统肿瘤分类 2016 修订版时,才单独分出此类疾病。
由于病变广泛累及肠道,特别是小肠部位,加之肿瘤细胞具有较强的侵袭和组织破坏能力,肠道的梗阻,溃疡,穿孔等并发症比较常见,很多病人因并发症起病,不得不先接受手术治疗;肠道病变导致的腹痛,腹泻等又常导致病人体重下降,明显消瘦,体力状态不佳。
由于疾病罕见,治疗经验积累困难,至今尚无标准的化疗方案。加之病程发展快, 有很多患者因急性肠梗阻或穿孔而接受急诊手术,导致腹膜炎、脓毒性休克和多器官衰竭,这些因素又导致化疗延迟,整体预后很差。
目前多数研究报道,平均生存时间仅为 7.5 个月。如果此类罕见淋巴瘤再遭遇复发难治困境,如何破局,争取治疗机会?CAR-T 能否获得疗效?在肠道病变的情况下,CAR-T 治疗的风险控制如何?近期我们中心收治了一例面临上述问题的复发难治的 MEIT 患者,现将治疗过程分享。
发病及诊断
患者,女,53 岁,14 个月前,右下腹疼痛,就诊于当地医院,超声示:左下腹低回声占位;腹盆腔増强 CT∶「左下腹软组织肿块,盲肠及升结肠近端肠管管壁不均匀增厚,盆腔积液。结肠癌?淋巴瘤不除外」。
遂行手术治疗,术中发现肠壁多发肿大淋巴结,行病变部位切除:小肠肿物、腹壁肿物、盲肠脂肪垂、阑尾。
检病理示:(小肠肿物、腹壁肿物、盲肠脂肪垂、阑尾),符合单形性亲上皮肠道 T 细胞淋巴瘤;免疫组化:CKp(-),C20(-),CD79a(-),Pax-5(-),CD3(+),CD5(-),CD4(部分+),CD8(+),CD43(+),Bcl-2(-),Bcl-6(-),CD10(-),CD30(-),Cmyc(-),TA1(-),Grb(-),CD56(-),EBER(-),Ki-67(60%+)。
诊断明确后完善 PET/CT:下腹部部分小肠术后改变 (SUVmax3.4),肠管及腹壁术区代谢弥散性增高 (SUVmax4.0),多考虑术后反应性改变;左中上腹部分空肠管壁增厚,代谢明显增高 (SUVmax8.9),淋巴瘤累及可能性大;骨髓穿刺及活检:未见肿瘤细胞侵犯。诊断:单形性亲上皮性肠道 T 细胞淋巴瘤,IIE 期(Musshoff 分期)。
外院治疗
外院诊断明确后,待患者手术后恢复即开始予 EPOCH 方案化疗 3 疗程,增强 CT 评估提示小肠术后改变, 小肠仍存在多发肠壁增厚, 肠系膜及腹膜后多增大淋巴结,但整体比治疗前有所改善。随后继续 EPOCH 化疗 3 疗程。
完成上述 6 疗程化疗后,患者再进行 PET-CT 评估,不幸的是发现疾病进展:下腹部小肠术后改变, 空回肠多处管壁明显增厚,代谢异常增高 (SUVmax 13.2), 考虑淋巴瘤浸润,与前片比较,肠管病变范围变广, 代谢增高, Deauvi1e 评分 5 分。
疾病进展后,为慎重起见,当地再送病理组织外院会诊,病理诊断再次确定为 MEIT。
随后进行了 2 周期的 DICE 方案化疗。
完成 2 周期化疗后,效果并不理想,患者腹痛症状明显加重,右下腹出现手可触及的包块。为进一步诊治,来我科。
入我院基本情况
患者入院时主诉: 右下腹持续胀痛,间断加重,尚可耐受,进食及排便尚正常。
入院生命体征: 体温 36.4℃;脉搏 100 次/分;呼吸 20 次/分;喜蜷卧位。左下腹可触及包块,约 5-7 cm 范围,由压痛。余未见明显异常体征。
血常规: 白细胞 1.44×10^9/L↓; 血红蛋白 66 g/L↓;血小板 237×10^9/L;中性粒细胞计数 0.65×10^9/L↓、淋巴细胞计数 0.45×10^9/L↓;
生化检查: 乳酸脱氢酶 168.7U/L;β2 微球蛋白 7.2 mg/L
复核病理: 可见明显溃疡,溃疡表面可见渗出。异常细胞弥漫增生浸润,细胞体积中等,胞浆少,核椭圆,染色质粗,核仁不明显,可见核分裂像。肿瘤细胞累及肠壁全层。阑尾及断端未见明显肿瘤细胞累犯。
免疫组化结果: 同原单位。
病理诊断:(小肠肿物、腹壁肿物、盲肠脂肪垂)肠道 T 细胞淋巴瘤。
思考:
成熟 T 细胞淋巴瘤种类繁多,不同类型的临床表现、治疗效果及预后差异性很大。
由于很多类型发病率较低,很难集中大量病例进行深入研究,积累临床治疗的经验,因此这些罕见疾病的治疗进展非常缓慢,多数都没有形成有效的一线标准治疗方案。
本例单形性嗜上皮肠道 T 细胞淋巴瘤就属于这种情况。由于发病部位常在小肠,当出现症状时往往已伴有肠梗阻,消化道出血甚至穿孔等严重并发症,提示病变比较广泛。
外科手术的介入在此类型淋巴瘤患者中更常见,一方面有助于并发症的治疗和获取病理组织明确诊断;但另一方面手术创伤也使患者接受化疗延迟,作为淋巴系统肿瘤,延迟化疗往往导致疾病进一步播散。因此病人初治时的情况就比较复杂。
本例患者的前期病情发展,符合这一典型过程。当患者能够接受化疗时,化疗方案通常选择 CHOP 或 CHOP 样的化疗为主,虽然疗效有限,但在没有更好的治疗方案前,仍是目前最常用的化疗方案。
NCCN 指南推荐的一线治疗方案为除上述之外,对身体状态好的患者,还可以采用更强烈的化疗,例如 EPOCH、Hyper-CVAD/MTX-Ara-C 交替等;在复发难治患者的治疗方面,更没有专门针对这类患者的治疗选择,无论是化疗,还是靶向药物,主要都是沿用外周 T 细胞淋巴瘤的方案。
本例患者经历了 6 疗程的一线化疗,2 疗程的二线化疗治疗,疾病始终进展,肠道病变范围扩大,面临治疗的困境。
既往我们中心针对 T 细胞淋巴瘤,采用 CD7 为靶点的 CAR-T 治疗临床试验,取得了不错的疗效,包括 T 淋巴母细胞淋巴瘤,皮肤 T 细胞淋巴瘤,血管免疫母 T 细胞淋巴瘤,肝脾 T 细胞淋巴,外周 T 细胞淋巴瘤非特指型等,初步证明的 CAR-T 细胞治疗 T 细胞淋巴瘤的安全性和有效性。但本例患者作为一个少见类型,既往尚无经验。
此外肠道病变,对于 CAR-T 治疗来说,存在高风险,主要是治疗中肠道病变在 CAR-T 的局部细胞因子炎症反应中可能出现的出血,穿孔风险较大,因此要慎重选择治疗时机。
根据上述情况,我们经过全科讨论,没有冒然选择直接进行 CAR-T 治疗,而将 CAR-T 治疗作为未来治疗的备选方案,暂时先开展减瘤化疗
我院治疗
减瘤治疗:
考虑患者减瘤化疗后需要桥接 CAR-T 治疗,而肠道病变 CAR-T 治疗中容易合并感染及出血等并发症,因此减瘤化疗不宜使用强度过高或骨髓抑制时间较长的化疗方案,结合患者既往化疗的疗效及耐药情况,我们选择了相对温和的 GEMOX 为基础的化疗方案, 同时联合了短疗程的 VP-16 和低剂量塞替派;经过减瘤化疗后患者病变得到控制,虽然仍存在节段性肠壁增厚,但 PET/CT 提示病变部位的代谢水平明显下降,说明肿瘤得到了控制。
化疗过程比较顺利,患者白细胞最低到 1.01×10^9/L;血小板保持在正常范围内 ;患者过程中未出现消化道出血。
减瘤后 CD7-CAR-T 治疗:
患者既往化疗的过程提示,患者单纯进行化疗治疗时疗效维持时间较短,因此,在取得上述疗效后,考虑到患者进行 CAR-T 治疗的风险明显下降,在和患者及家属充分沟通后,我们启动了 CD7-CAR-T 的治疗。
清淋预处理方案采用标准的福达拉滨联合环磷酰胺治疗,在 CAR-T 回输方面,考虑到治疗相关风险,再结合我们既往 CD7-CAR-T 治疗的经验,我们采取了剂量控制回输,输注细胞数仅为 1.12*10^5/kg。
CAR-T 回输后我们采用了消化道出血密切监测,抢先预防等手段,积极防治消化道并发症。患者整体过程较为平稳,未出现最令人担心的腹痛腹胀,消化道出血等情况。
出现 1 级 CRS 反应,于输注后第 8 天开始,主要表现为持续发热,最高 39.5℃,经过积极控制后 4 天缓解。无 ICANS 发生。
尽管输注剂量较少,但和我们的预计一样,患者 CAR-T 体内扩增良好,CAR-T 扩增峰值达到 10^7/L 水平。持续时间达 60 天。从外周血细胞监测来看,CD7+T 细胞持续抑制,间接体现了 CD7-CAR-T 对 CD7+靶细胞的清除作用。可见下图
疗效评估
患者 CAR-T 细胞回输后,特别是 CRS 反应结束,患者自觉症状明显好转,腹痛腹胀基本消失,饮食及排便均恢复正常。
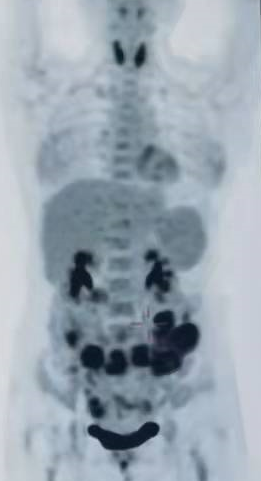
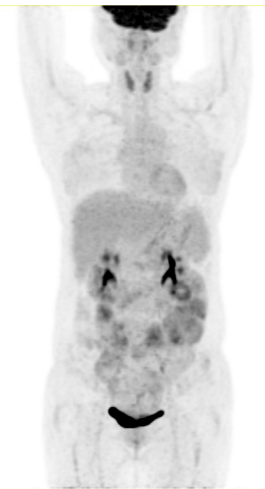
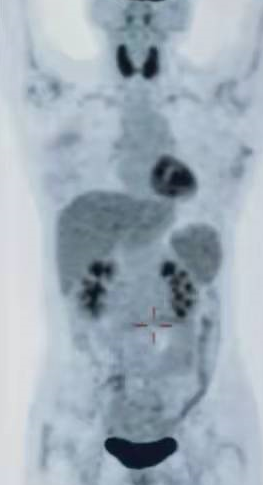
在治疗后 90 天,复查 PET/CT 显示病变达到了接近完全缓解状态。整体治疗过程中的 PET 监测如下图所示(治疗前,减瘤后,CAR-T 后):
编辑搜图
入院治疗前
编辑搜图
减瘤化疗后
编辑搜图
CAR-T2
治疗后 90 天
思考:
本例患者作为肠道病变为主的特殊少见类型 T 细胞淋巴瘤,在我们接诊时主要面临着环环相扣的三个问题:
1. 化疗后复发的肠道疾病,能否有有效的化疗方案控制病情,缩小病灶?
2. 肠道受累患者进行 CD7-CAR-T 治疗的风险如何规避,疗效如何保证?
3. 如何控制治疗后复发,达到长期缓解?
该患者只有解决了第一个问题,第二个问题才有可能实施,而第二个问题如果能顺利解决,才有机会探讨第三个问题。
对于胃肠道受累的淋巴瘤患者 CAR-T 治疗是否增加治疗相关并发症以及 CAR-T 疗效是否受影响,目前的研究数据来看还存在争议,尽管多数研究得到较为乐观的结论,认为不增加消化道并发症的发生,但我们对此类患者仍保持相当谨慎的态度,因为一旦在 CART 治疗中出现穿孔,出血等并发症,往往是致命的。本例患者的前期减瘤较为有效,大大消减的肿瘤负荷,从而降低了上述风险,是后续 CAR-T 治疗安全进行的前提条件。
这类患者,在 CAR-T 治疗中除了常规的 CRS,ICANS,感染等并发症的防治,对消化道并发症的预防及抢先治疗也至关重要。
在 CAR-T 疗效方面,最新的研究发现,淋巴结以外重要脏器的基础疾病或淋巴瘤侵犯对疗效及长期预后均存在不良影响,因此要对这些患者 CAR-T 的近期及远期疗效密切监测,必要时要及时调整治疗策略。
本例患者面临的第三个问题是长期缓解问题,目前尚未得到解决,患者后续是否需要移植的介入,是采用自体移植还是异体移植,由于可借鉴的经验太少,是目前我们仍在思考的问题……
好文章,需要你的鼓励
















