11 月 8 日,由河南省肿瘤医院罗素霞教授研究团队开展的一项关于晚期食管鳞状细胞癌(以下简称「ESCC」)治疗,在《Signal Transduction and Targeted Therapy》期刊上发表研究论文《First-line benmelstobart plus anlotinib and chemotherapy in advanced or metastatic/recurrent esophageal squamous cell carcinoma: a multi-center phase 2 study》(贝莫苏拜单抗联合安罗替尼和化疗一线治疗晚期/复发转移的食管癌的多中心 II 期研究),影响因子 40.8。该团队罗素霞教授为项目牵头人及通讯作者,消化内科李宁为共同第一作者。

此项研究聚焦于一线治疗不可切除局部晚期、复发性或转移性食管鳞癌,提出了 PD-L1 单抗 (贝莫苏拜单抗) 联合安罗替尼及化疗的联合治疗(以下简称「TQB2450-II-13」)策略,并评估其疗效和安全性。中位无进展生存期(mPFS)为 14.9 个月,中位总生存期(mOS)未达到,且探索性分析显示患者生存获益不受 PD-L1 表达水平的影响。
PD-L1 低表达晚期 ESCC 免疫治疗获益不佳 免疫治疗联合抗血管生成治疗成为重要探索方向
河南省肿瘤医院药物临床试验机构主任、I 期临床研究中心主任罗素霞表示,晚期食管癌的 5 年生存率低,近年来,随着免疫治疗的兴起与发展,食管癌已全面进入免疫治疗时代。随着临床数据的不断积累,相关研究致力于探索更丰富、治疗效果更优的免疫治疗模式,力求进一步改善患者预后。而现阶段未能从免疫治疗中获益的 PD-L1 TPS<1% 的晚期 ESCC 患者,成为临床研究的关注重点。在此背景下,免疫治疗联合抗血管生成药物及化疗模式成为研究者的探索方向之一。
河南省肿瘤医院消化内科主任医师李宁介绍,目前免疫联合化疗为晚期 ESCC 的标准治疗方案,但领域内仍存在较大未被满足的临床需求。数据显示,约 30% 晚期食管癌患者对一线免疫治疗无响应,且化免联合方案的疗效有限,带来的中位无进展生存期(mPFS)约为 7.3 个月。相当一部分晚期 ESCC 患者未能从免疫治疗中获益,研究者开始关注特殊类型 ESCC,尤其是 PD-L1 低表达人群接受免疫治疗的获益情况。
PD-L1 单抗联合安罗替尼及化疗四药联合方案疗效瞩目 且不受 PD-L1 表达限制
TQB2450-II-13 研究是一项单臂、多中心 II 期临床研究,旨在评估 PD-L1 抑制剂联合安罗替尼、紫杉醇和顺铂一线治疗不可切除局部晚期、复发性或转移性 ESCC 的疗效和安全性。符合条件的患者接受 PD-L1 单抗联合安罗替尼及紫杉醇和顺铂治疗 4-6 个周期,未出现疾病进展的患者继续接受 PD-L1 单抗联合安罗替尼维持治疗直至疾病进展或无法耐受。主要终点是根据 RECIST v1.1 评估的 PFS(无进展生存时间),次要终点是肿瘤缓解、OS(总生存时间)和安全性。
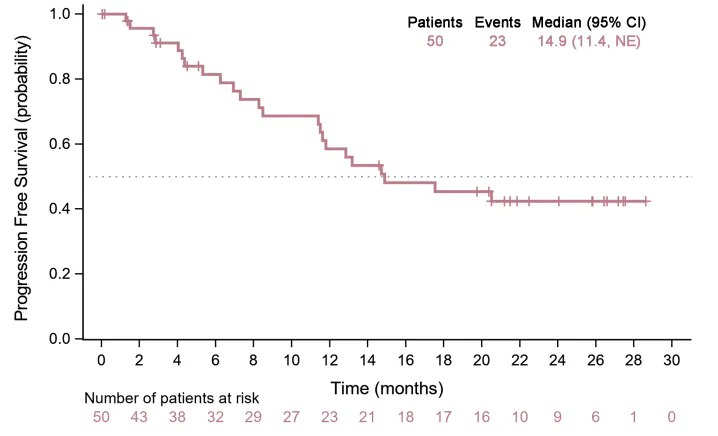
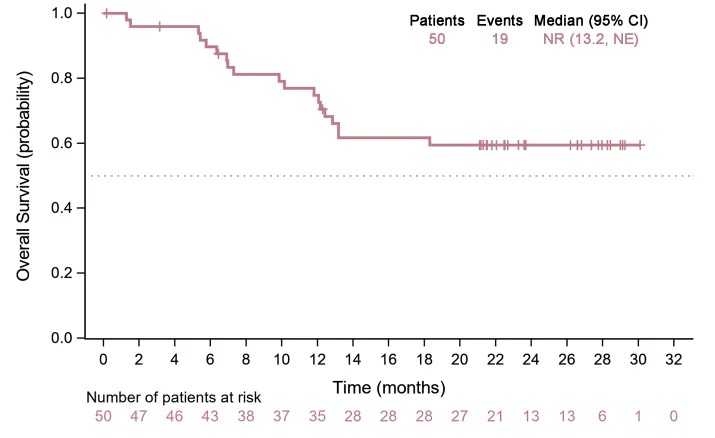
TQB2450-II-13 研究的中位总生存期 mOS
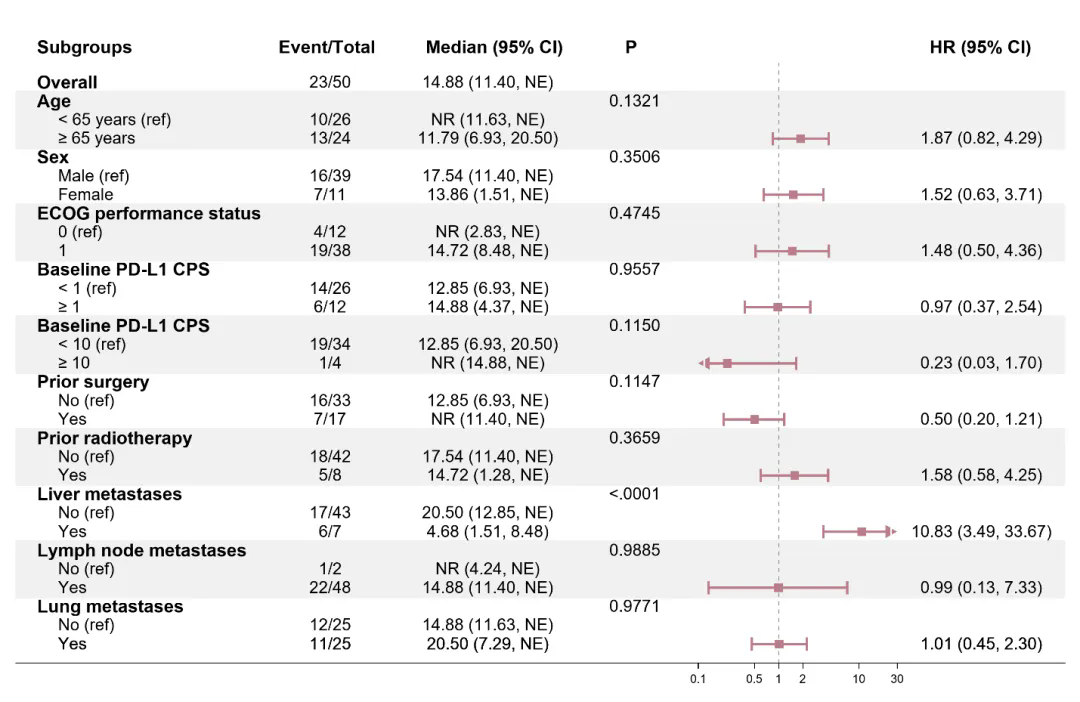
TQB2450-II-13 研究亚组分析结果 mPFS
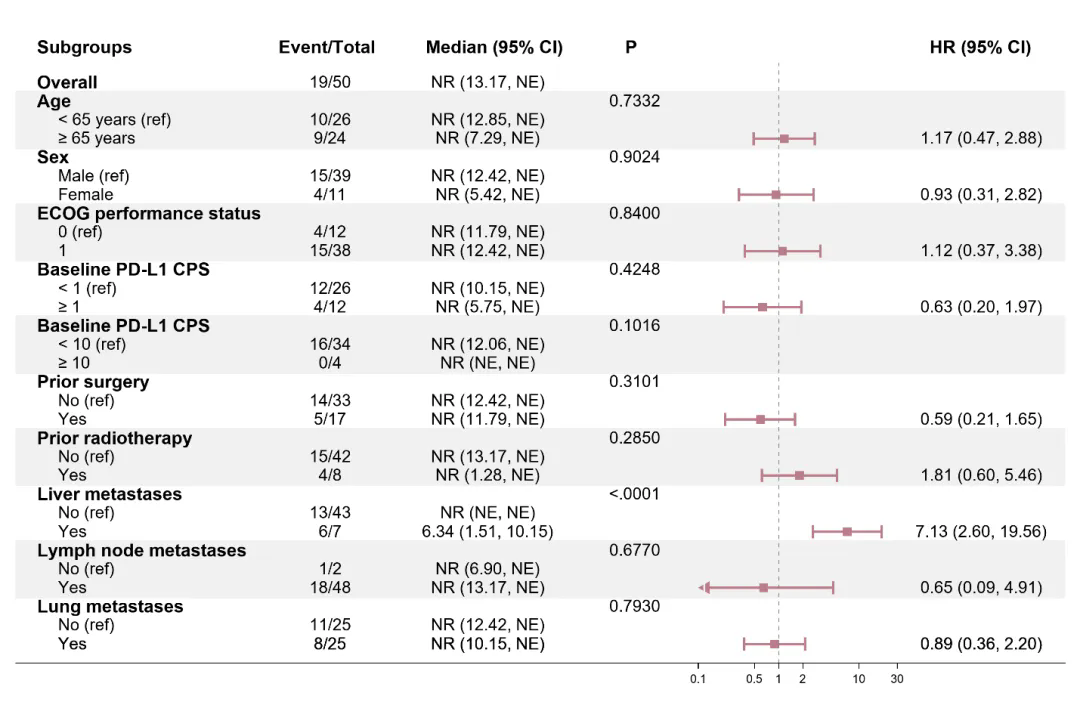
TQB2450-II-13 研究亚组分析结果 mOS
研究结果表明,PD-L1 单抗联合安罗替尼及化疗的四药方案,在不可切除的局部晚期、复发性或转移性 ESCC 患者中展现出良好的疗效和可控的安全性,且患者生存获益不受 PD-L1 表达水平的影响。
罗素霞介绍,安罗替尼和 PD-L1 单抗均为我国自主研发的抗肿瘤药物,其中安罗替尼为一款新型小分子、多靶点酪氨酸激酶抑制剂(TKI),可从促进血管基质重编程、改善肿瘤细胞重编程、调节肿瘤免疫微环境三个方面全面调控肿瘤微环境重编程;PD-L1 单抗(贝莫苏拜单抗)为一款全新序列的创新人源化抗 PD-L1 单克隆抗体,可阻止 PD-L1 与 T 细胞表面的 PD-1 和 B7.1 受体结合,使 T 细胞恢复活性,从而增强免疫应答。基于免疫联合抗血管生成及化疗的协同增效效应,TQB2450-II-13 研究中 PD-L1 单抗+安罗替尼+化疗四药方案展现出独特的疗效优势及可控的安全性。
好文章,需要你的鼓励
















