高尚医学影像诊断中心 病例
病史摘要
患者男,48 岁。因腹部 CT 示腹膜后巨大占位,拟行 PET/CT 进一步评估腹部病灶及全身情况。
PET/CT 全身 MIP 图
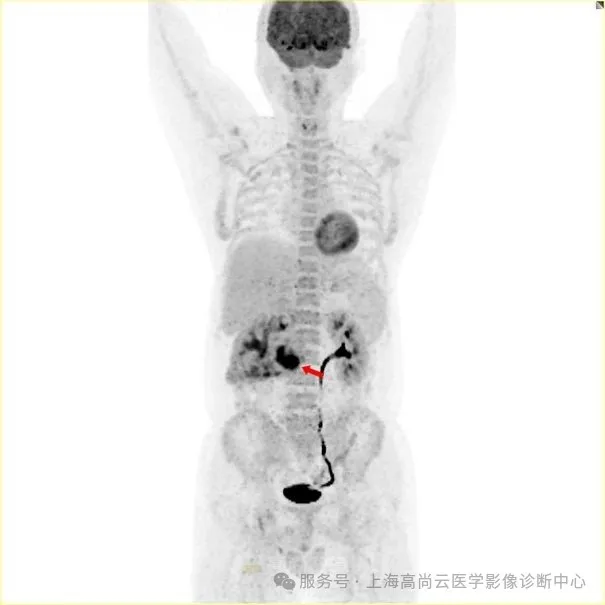
图一:PET 全身 MIP 图;箭头所指为腹部 FDG 摄取增高灶。
PET/CT 融合图
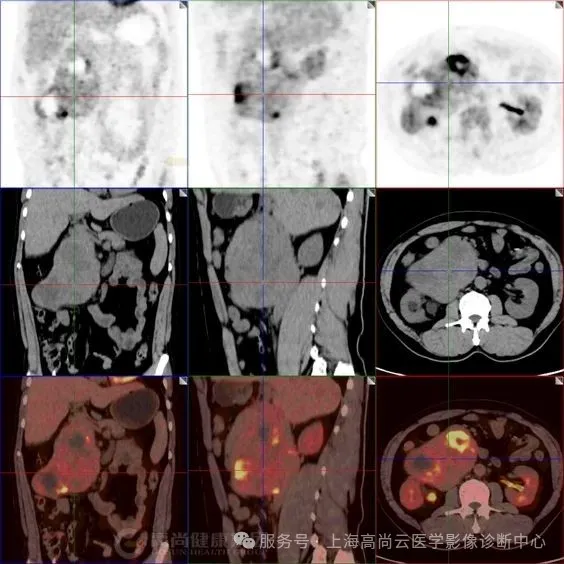
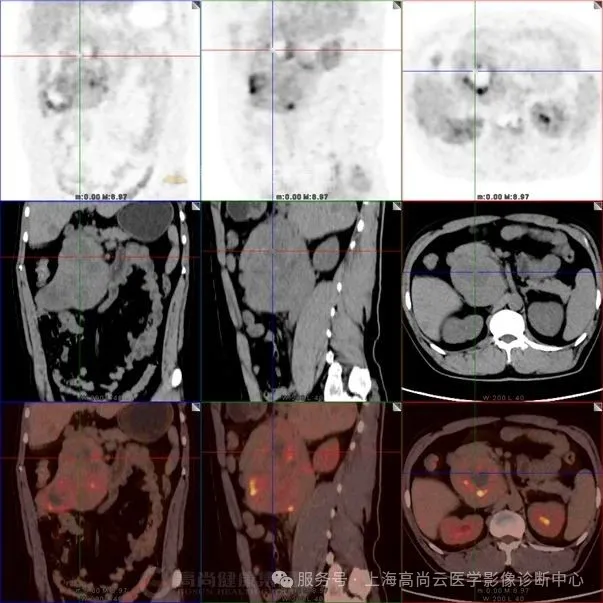
图二:右侧腹腔大片不均匀 FDG 摄取异常增高影,SUVmax 约介于 3.3~12.0 之间,范围约 12.7 cm×7.1 cm×13.5 cm,CT 于上述部位见巨大软组织占位,分叶状,边界清晰,其中见多个低密度影,CT 值介于 17.0 Hu~44.0 Hu 之间,病灶推挤邻近下腔静脉,推挤邻近胰头部、十二指肠,累及右肾下极、右侧输尿管上段及右侧腰大肌
PET/CT 融合图
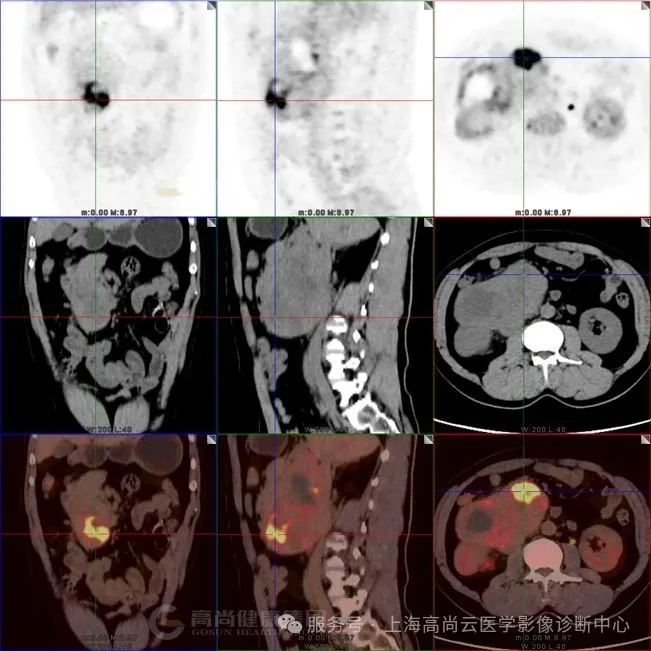
图三:腹腔肿块内 FDG 摄取最高部位,SUVmax 约 12.0。
PET/CT 融图
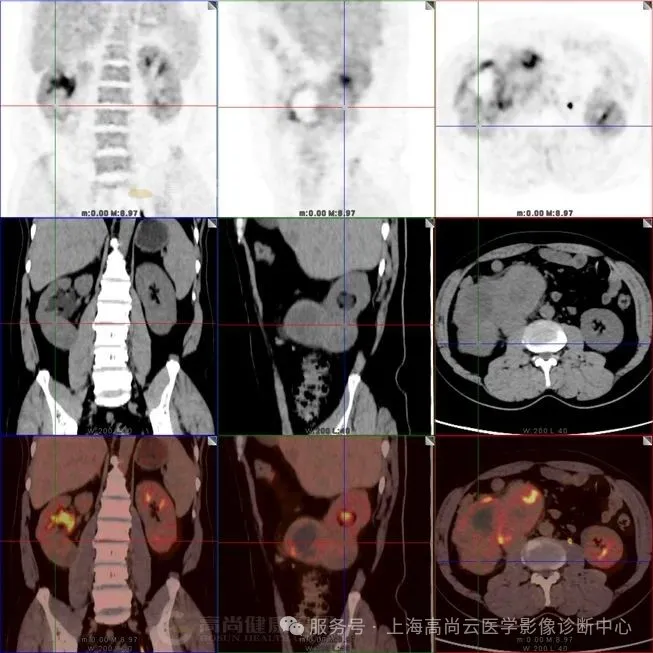
图四:肿块与腰大肌分界不清,提示侵犯。
PET/CT 融合图
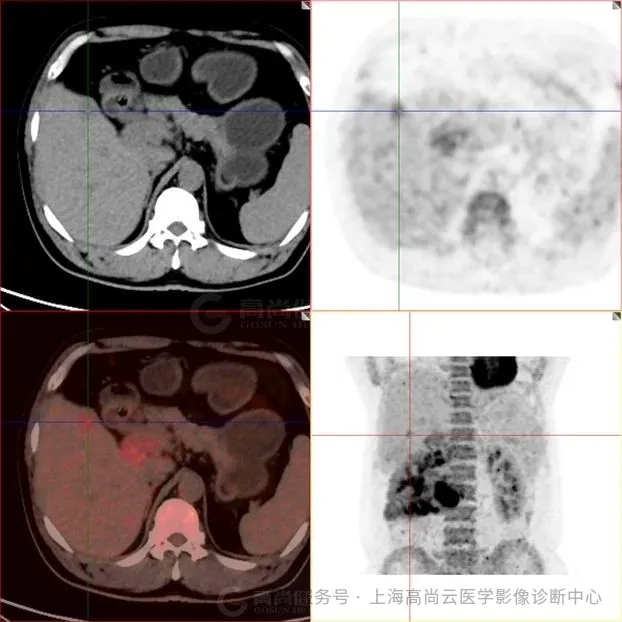
图五:肿块内见多发低密度区,该局部 FDG 摄取降低。
PET/CT 融合图
PET/CT 融合图
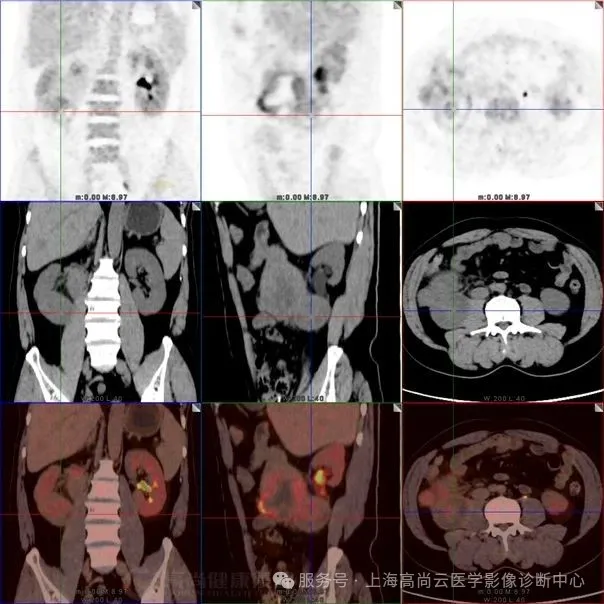
图六:肿块与肾脏下极实质分界不清,提示肾脏侵犯。
PET/CT 融合图
PET/CT 融合图
PET/CT 融合图
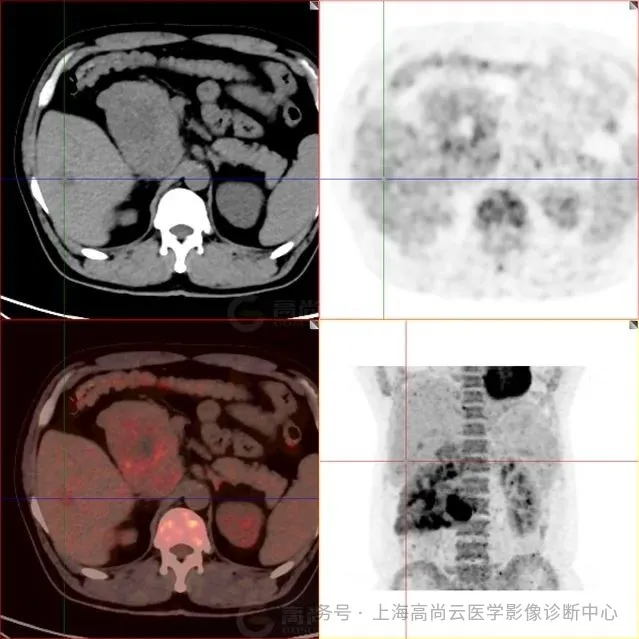
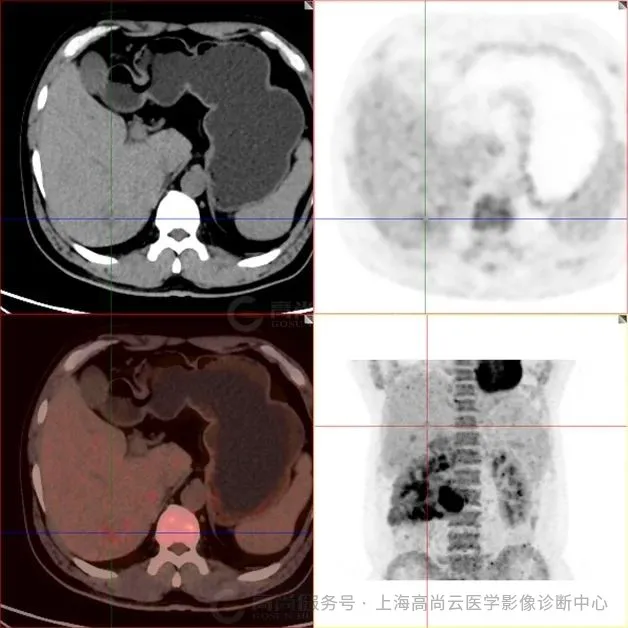
图 7-9:肝实质内多发低密度灶,FDG 摄取轻度增高,SUVmax2.9,延迟显像后 SUVmax 约 4.1
PET/CT 报告结论:
1. 腹膜后区(右侧)巨块状不均匀高代谢病灶,肿瘤累及右肾下极、右侧输尿管上段及右侧腰大肌,可疑下腔静脉受累;
2. 肝脏多发稍低密度影,代谢轻度增高,考虑为转移
三、肿块穿刺活检病理
未分化脂肪肉瘤
讨论
一、脂肪肉瘤简介:
脂肪肉瘤(Liposarcoma, LPS)是一种起源于脂肪组织的恶性间叶源性肿瘤,约占所有软组织肉瘤的 15%-20%[1]。根据 2020 年 WHO 软组织肿瘤分类,脂肪肉瘤主要分为以下四种亚型:[2]
1. 高分化脂肪肉瘤(WDLS):低度恶性,含成熟脂肪细胞,易局部复发但罕见转移。
2. 去分化脂肪肉瘤(DDLS):由高分化成分和高级别非脂肪性肉瘤组成,侵袭性强。
3. 黏液样/圆形细胞脂肪肉瘤(MLS/RCLS):中等恶性,易转移至腹膜后和软组织。
4. 多形性脂肪肉瘤(PLS):高度恶性,预后最差。
不同亚型的生物学行为、影像学表现及治疗。方案差异显著,因此精准诊断至关重要。
二、流行病学特征:
脂肪肉瘤好发于 40-60 岁中老年人,男性略多于女性(男女比例约 1.2:1)[3]。发病部位以腹膜后(40%-45%)和四肢深部软组织(尤其是大腿,35%-40%)最常见,少数见于纵隔、精索或乳腺 [4]。流行病学研究显示,脂肪肉瘤的年发病率约为 2.5 例/100 万人,占所有恶性肿瘤的不到 1%。[5]
三、诊断标准与影像学特点:
1. 病理诊断:
金标准:穿刺活检或手术切除标本的组织病理学检查,结合免疫组化(如 MDM2、CDK4 扩增检测)[6]。
分子检测:DDLS 和 WDLS 常存在 12q14-15 区(MDM2/CDK4)扩增,而 MLS/RCLS 多伴有 FUS-DDIT3 或 EWSR1-DDIT3 融合基因 [7]。
2. 影像学表现:
(1)CT 与 MRI
高分化型:CT 呈脂肪密度(-50 至-100 HU),MRI T1WI 高信号,增强扫描无强化 [8]。
去分化型:CT 显示脂肪+实性成分,实性部分强化明显,MRI T2WI 呈高信号 [9]。
黏液样型:MRI T2WI 显著高信号(「羽毛状」改变),增强后不均匀强化 [10]。
(2)PET/CT 的核心价值
鉴别良恶性:高分化型 SUVmax 通常<2.0,而去分化型、多形性型 SUVmax 常>2.5[11]。
分期与转移检测:PET/CT 对淋巴结、肺及骨转移的检出率优于常规 CT[12]。
疗效评估:治疗后 SUVmax 下降>30% 提示治疗有效 [13]
四、预后因素:
| 亚型 | 5 年生存率 | 主要预后因素 |
| 高分化型 | >80% | 手术完整性 |
| 去分化型 | 40%-60% | 去分化比例 |
| 黏液样/圆形细胞型 | 60%-75% | 圆形细胞占比 |
| 多形性型 | <30% | 转移与否 |
不良预后因素:肿瘤>5 cm、高级别、切缘阳性、远处转移 [14]。
总结:
PET/CT 在脂肪肉瘤的诊断、分期、疗效监测中具有重要价值,尤其对高级别亚型(如 DDLS、PLS)的代谢评估优于传统影像。未来,分子靶向治疗+精准影像可能进一步改善患者预后。
参考文献:
1.Fletcher CDM, Bridge JA, Hogendoorn PCW, et al., eds. WHO Classification of Tumours of Soft Tissue and Bone. 4th ed. IARC Press; 2020.
2.Thway K, Jones RL, Noujaim J, Zaidi S, Miah AB, Fisher C. Dedifferentiated liposarcoma: updates on morphology, genetics, and therapeutic strategies. Histopathology. 2014;64(1):38-52. doi:10.1111/his.12281
3.Dei Tos AP, Pedeutour F. Atypical lipomatous tumour/well-differentiated liposarcoma. In: Fletcher CDM, Unni KK, Mertens F, eds. Pathology and Genetics of Tumours of Soft Tissue and Bone. IARC Press; 2002:35-37.
4.Lahat G, Madewell JE, Anaya DA, et al. Computed tomography scan-driven selection of treatment for retroperitoneal liposarcoma histologic subtypes. Ann Surg Oncol. 2008;15(6):1589-1597. doi:10.1245/s10434-008-9915-0
5.Ducimetière F, Lurkin A, Ranchère-Vince D, et al. Incidence of sarcoma histotypes and molecular subtypes in a prospective epidemiological study with central pathology review and molecular testing. Eur J Cancer. 2011;47(17):2606-2615. doi:10.1016/j.ejca.2011.08.002
6.Dalal KM, Antonescu CR, Singer S. Diagnosis and management of lipomatous tumors. Clin Cancer Res. 2006;12(3 Pt 1):700-706. doi:10.1158/1078-0432.CCR-05-1967
7.Taylor BS, DeCarolis PL, Angeles CV, et al. Frequent alterations and epigenetic silencing of differentiation pathway genes in structurally rearranged liposarcomas. Cancer Discov. 2011;1(7):587-597. doi:10.1158/2159-8290.CD-11-0181
8.Tateishi U, Hasegawa T, Beppu Y, Satake M, Moriyama N. Primary dedifferentiated liposarcoma of the retroperitoneum: prognostic significance of computed tomography and magnetic resonance imaging features. Radiographics. 2005;25(5):1371-1390. doi:10.1148/rg.255055030
9.Schwarzbach MH, Dimitrakopoulou-Strauss A, Mechtersheimer G, et al. Assessment of soft tissue lesions suspicious for liposarcoma by F18-deoxyglucose (FDG) positron emission tomography (PET). Eur Radiol. 2005;15(9):1877-1887. doi:10.1007/s00330-005-2698-9
10. Kransdorf MJ, Bancroft LW, Peterson JJ, Murphey MD, Foster WC, Temple HT. Imaging of fatty tumors: distinction of lipoma and well-differentiated liposarcoma. Radiographics. 2002;22(6):1339-1352. doi:10.1148/rg.226025123
11. Ioannidis JP, Lau J. 18F-FDG PET for the diagnosis and grading of soft-tissue sarcoma: a meta-analysis. J Nucl Med. 2003;44(5):717-724.
12. Benz MR, Czernin J, Allen-Auerbach MS, et al. FDG-PET/CT imaging predicts histopathologic treatment responses after neoadjuvant therapy in adult primary soft-tissue sarcomas. J Nucl Med. 2010;51(2):238-242. doi:10.2967/jnumed.109.068304
13. Evilevitch V, Weber WA, Tap WD, et al. Reduction of glucose metabolic activity is more accurate than change in size at predicting histopathologic response to neoadjuvant therapy in high-grade soft-tissue sarcomas. Clin Cancer Res. 2008;14(3):715-720. doi:10.1158/1078-0432.CCR-07-1762
14. Zagars GK, Goswitz MS, Pollack A. Liposarcoma: outcome and prognostic factors following conservation surgery and radiation therapy. Int J Radiat Oncol Biol Phys. 1996;36(2):311-319. doi:10.1016/S0360-3016(96)00265-9
好文章,需要你的鼓励
















