近日,复星诊断新冠病毒抗原检测试剂盒获得德国联邦药品和医疗器械管理局(BfArM)批准,被列入「白名单」,产品可在德国境内销售。德国联邦药品和医疗器械机构(BfArM),隶属于德国联邦卫生部,负责德国
近日,复星诊断新冠病毒抗原检测试剂盒获得德国联邦药品和医疗器械管理局(BfArM)批准,被列入「白名单」,产品可在德国境内销售。
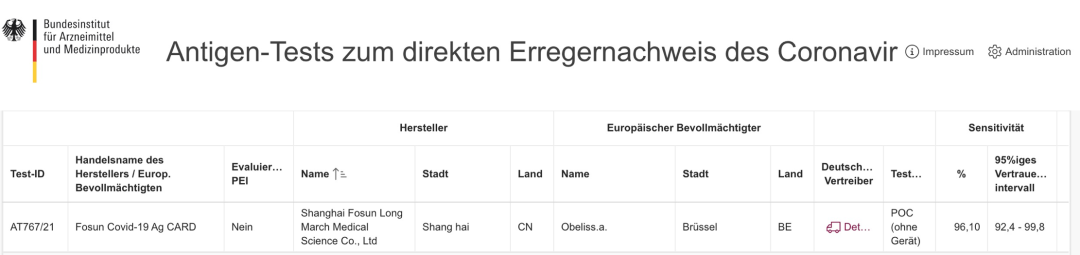
德国联邦药品和医疗器械机构(BfArM),隶属于德国联邦卫生部,负责德国医药产品的注册审批和监管
3 月 1 日起,德国已开展全民免费新冠抗原检测服务,这对新冠抗原检测产品的质量与产量提出了严格要求。「白名单」是欧洲各国卫生部为保证进口医疗产品质量,在 CE 门槛基础上设置的国家卫生系统制度,只有具备过硬的品质,优良的信誉才能通过严格的审核流程,获得销售许可。
复星诊断新冠病毒抗原检测试剂盒采用胶体金法定性检测人鼻拭子、咽拭子与深部吸痰样本中的新冠抗原,可用于新冠早期诊断。试剂准确性高,与 PCR 相比,阳性符合率 93.0%,阴性符合率 99.1%。
试剂盒操作简单,无需其他设备,除专业医技人员之外的其他医护人员也可轻松操作,可改善全球核酸检测的超负荷状况,高效应对不能立即获得核酸检测的偏远地区、机构和半封闭社区的疑似 COVID-19 疫情。15 分钟快速获取结果,可满足疫情防控下的快速检测需求。
产品已获 NMPA、CE、FDA EUA、WHO EUL 以及 TGA 等认证。300 copies/mL 的灵敏度最大程度防止漏检;与临床诊断结果相比总体符合率达 98.48%,保证结果准确可靠。
产品检测自然感染或特定疫苗产生的抗棘突/RBD 蛋白的中和抗体活性,15 分钟获取报告,适用于个体免疫状态评估。
复星诊断将持续关注全球疫情,坚守质量,不负使命,助力新冠病毒疫情防控工作!
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
封面图来源:站酷海洛
好文章,需要你的鼓励
















