张永红教授:让每一例淋巴瘤患儿都能得到规范诊治,将儿童淋巴瘤的治愈率提高再提高,尤其是难治复发儿童淋巴瘤的治疗,是我及团队一直努力的方向,即使我们团队初治儿童淋巴瘤的治愈率已经达到 80% 以上,有些
张永红教授:让每一例淋巴瘤患儿都能得到规范诊治,将儿童淋巴瘤的治愈率提高再提高,尤其是难治复发儿童淋巴瘤的治疗,是我及团队一直努力的方向,即使我们团队初治儿童淋巴瘤的治愈率已经达到 80% 以上,有些类型甚至达 90% 以上,但仍有难治复发患者的诊断与治疗存在挑战。
为此,我们开设「儿童淋巴瘤大查房」这一专栏,搭建交流平台,分享我们的诊疗经验。一方面让我们的患儿家属及时了解最新的临床诊疗技术,树立信心,少走弯路。另一方面,在我们分享的这些疑难病的诊断与治疗过程中,汇集了整合诊断专家与临床专家的智慧和力量。
将我们的诊疗经验和国内的同道分享交流,希望同各位同仁一起共同为提升国内儿童淋巴瘤诊治水平,缩小同国际的差距而努力,正如 2017 年牵头成立全国儿童淋巴瘤协作组的初心一样,让每一例淋巴瘤患儿都能得到规范诊治。
儿童淋巴瘤大查房栏目将每两月推出一期,欢迎大家持续关注。
一、病例介绍
1. 病史:
患儿,女,2 岁,2019 年 3 月无明显诱因家长发现患儿右后胸壁肿物,就诊于北京某医院。查体示右侧后胸壁可见大小约 4 cm×4 cm×1 cm 包块,质韧,无触痛,移动度差。胸背 B 超可见右后下纵膈肿物,范围约 4.5×2.2×8.8 cm,右侧前胸壁下壁胸膜不均增厚,双侧胸骨旁可见异常形态淋巴结,右侧胸腔积液,考虑为淋巴瘤。
腹部 B 超示右肾皮质内可见低回声结节,大小 0.7×0.9×0.8 cm。2019-4-2 全麻下行 B 超引导下纵膈肿物穿刺活检,2019-4-3 北京儿童医院病理:(纵隔肿瘤穿刺)淋巴造血系统肿瘤,结合免疫组化符合 B 淋巴母细胞淋巴瘤/白血病。
免疫组化结果:LCA(+),PAX-5(+),CD38(+),CD20(散在+),CD22(部分弱+),CD3(-),CD7(-),CD10(个别+),Ki-67(60%+),CD34(-),CD99(-),TdT(少量弱+),CK(AE1/AE3)(-),BcL-2(+),Bcl-6(-),c-Myc(10%+),P53(+),MP0(-),CD33(-),CD1a(-),CD19(-),PD-1(-),PD-L1(-),CD23(-),CD30(-)。原位杂交结果:EBER(-)。
术后病理送北京友谊医院周晓鸽教授会诊结果同样为 B 淋巴母细胞淋巴瘤/白血病,行骨穿骨髓形态示原幼淋占 2%,遂于 2019 年 4 月 17 日转入高博医疗集团北京博仁医院治疗。
2. 入院查体:
精神可,脉搏:124 次/min,呼吸:24 次/min,血压:83/45 mmHg。身高:99 cm,体重:10 kg。面色正常,皮肤无黄染、瘀斑及皮疹,毛发无脱落,浅表淋巴结未及肿大,颈软,无抵抗,无颈静脉怒张,气管居中,右后胸壁可见一隆起包块,质硬,大小为 6 cm×5 cm×1.5 cm,活动度差,无触痛,心前区无隆起,未及心尖搏动,心音有力,各瓣膜区未闻及杂音,双肺呼吸音清,对称,未闻及干湿啰音,未触及胸膜摩擦感,腹不胀,肝脾肋下未及,移动性浊音阴性,中枢神经系统查体未见异常。
3. 入院化验及检查结果:
● 血常规:白细胞 5.80×109/L;中性粒细胞计数 3.29×109/L;血红蛋白 126 g/L;血小板 434×109/L↑;C 反应蛋白<10.00 mg/L 生化:ALT 35.90U/L↑;AST 11.70U/L;尿酸 296.00umol/L;肌酐 29.30umol/L↓;尿素 4.02 mmol/L 乳酸脱氢酶 416.00U/L↑;钾 4.08 mmol/L;钙 2.53 mmol/L↑;磷 1.59 mmol/L↑;白蛋白 46.30 g/L;D-二聚体测定 0.19;FIB 5.79ug/mL↑;
● 头部 MRI 平扫双侧颧骨、蝶窦、左侧腮腺内异常信号,考虑淋巴瘤侵犯;双侧咽旁肿大淋巴结,左侧活性灶可能。颈胸部 MRI 平扫:颈根部见多发肿大淋巴结,纵隔内沿前上纵隔后缘、右侧胸膜、后纵膈见不规则肿块,胸膜肿块范围约 32 mm×8 mm。
头部 MRI 平扫双侧颧骨、蝶窦、左侧腮腺内异常信号,考虑淋巴瘤侵犯;双侧咽旁肿大淋巴结,左侧活性灶可能。
颈胸部 MRI 平扫:颈根部见多发肿大淋巴结,纵隔内沿前上纵隔后缘、右侧胸膜、后纵膈见不规则肿块,胸膜肿块范围约 32 mm×18 mm×8 mm,右侧胸膜腔少量积液;
后纵隔肿块通过椎间孔向椎管内硬膜外生长,椎管外肿块 120 mm×39 mm×16 mm,椎管内肿块 76 mm× 12 mm×7 mm;
全脊柱多发椎体及附件、双侧肱骨、右侧尺桡骨、左侧尺骨,胸骨、右侧部分前肋信号异常;
右肾下极肾实质内见类圆形肿块影,直径约 9 mm;左肾下极水平腹膜后似见多发肿大淋巴结;
肝脏、脾脏、胰腺及左肾未见异常信号。PET-CT 示:右侧胸腔巨大占位病变 104 mm×59 mm×40 mm,SUV 值 max 3.9,葡萄糖代谢增高,符合淋巴瘤表现;
病变侵犯右侧胸壁及 T9-12 层面椎管;
右侧胸膜弥漫性受侵犯;
纵隔 2R 区、膈上前组、右侧腋窝、右锁骨上窝淋巴结浸润;
全身多发骨浸润灶。
● 骨髓形态示异常淋巴细胞占 29.5%,骨髓流式:可见 9.24% 异常表型成熟 B 淋巴细胞,表达 CD22、cCD79a、Lambda、CD38、CD58、HLA-DR,不表达 CD34、TdT、CD99、CD10、CD20、Kappa、clgM、CD43、CD3、CD7、CD56、CD33、CD117、CD15,Ki-67 表达率为 53.79%。
● 综上,瘤灶极其广泛,累及后纵膈、胸膜、胸壁、肾脏、腮腺、咽旁淋巴结、腋窝淋巴结、锁骨上淋巴结、多发骨浸润、骨髓。因骨髓流式免疫分型与纵膈肿物病理诊断不一致,活检组织少,进一步检查困难,故于 2020-4-25 再次行超声引导下二次纵膈活检,当天返院后行二次骨髓流式分型检查。
● 2020-4-30 二次活检病理周春菊主任报告:(纵隔肿物)淋巴造血系统肿瘤,结合免疫组化及分子生物学基因检测考虑病理诊断∶(纵隔肿物)B 淋巴母细胞淋巴瘤/白血病伴 t(v; 11q23); MLL/AF9 重排。
免疫组化结果∶ CD19(+),PAX-5(+),Ki-67(50%+),TdT(偶见+),CD99(小灶+),CD3(-),CD10(-),CD34(-),CD22(+), CD38(+),CD20(少量+),BcL-2(+),BeL-6(+),c-Myc(-), Kappa(部分+),Lambda(-),CD117(-),CD163(-)。
(胸骨骨髓甩片)可见大量中性粒细胞,少量淋巴细胞。免疫组化;CD19(少量弱+),TDT(-),Kappa(散在弱+),Lambda(-),CD99(-)。
● 2020-5-13 病理科高子芬教授会诊回报:第一次穿刺组织,全部为肿瘤组织。细胞体积中等大小,胞浆少,核不规则,可见核内包涵体,核仁明显,红,单核为主,染色质细,核分裂象易见。
原单位免疫组化:BCL2 (+>50%), BCL6 (-), CD21a(-), CD3ε (-),CD7 (-), CD19×2 (+), CD20×2 (+) , CD22×2(弱+), CD23 (-), CD30(-),CD33 (-), CD34(-),CD38 (+), CD99×2 (-), MYC (40% 弱+), CK(-) ,Desmin(-), Ki67 (80%+) , LCA (+),, Myogenin (-), MPO(-) , PD-1 (-), PD-L1 (-), P53 (++,野生型),,Pax5 (+), Syn (-), TdT×3(-):原位杂交: EBER(-)。
第二次穿刺组织, 可见肌肉及皮肤。全部为肿瘤组织。细胞体积中等大小,胞浆少,核不规则,可见核内包涵体,核仁明显,红,单核为主, 染色质细,核分裂像易见。原单位免疫组化: BCL2 (+>50%), BCL6 (+), CD19 (+),,CD20 (少部分+), CD22 (广泛弱+),CD38(+), CD99(-),,Ki67 (70%+),,Kappa (少量+), Pax5 (+)。
骨髓细胞沉渣蜡块内以粒细胞为主,单个核细胞少。原单位免疫组化: CD19(-),CD99(-),Kappa(-),Lambda (-),TdT(-)。特殊检查:CD10-,CD99-,TdT-,CD34-。
诊断:(纵隔) 穿刺组织:弥漫大 B 细胞淋巴瘤,非特指型。非生发中心 B 细胞起源 (Hans 模型) 注:本例形态不是母细胞特点,增加标记 (CD10,CD99,TdT,CD34) 均未获得母细胞标记,瘤细胞很好地表达 CD20,增殖活性较高。目前为双表达淋巴瘤,建议行 FISH (BCL-2, BCL-6, MYC) 检测以鉴别双重打击淋巴瘤。
● 骨髓融合基因回报:MLL-AF9 融合基因阳性;
● 骨髓染色体:46, XX[20]。
● 骨髓流式:可见 35.67%(占全部细胞)的 CD19dim/CD45dim 细胞,表达 CD22、CD81dim、CD58 和 CD38,部分表达 Lambda(dim),不表达 CD34、TdT、CD20、CD10、Kappa、CD123、CD66c 和 NG2。为异常成熟 B 淋巴细胞。
● 加做骨髓细胞遗传学结果回报提示骨髓 FISH:MYC(-)BCL-2(-)BCL-6(-)MLL(+);(如下图一所示)
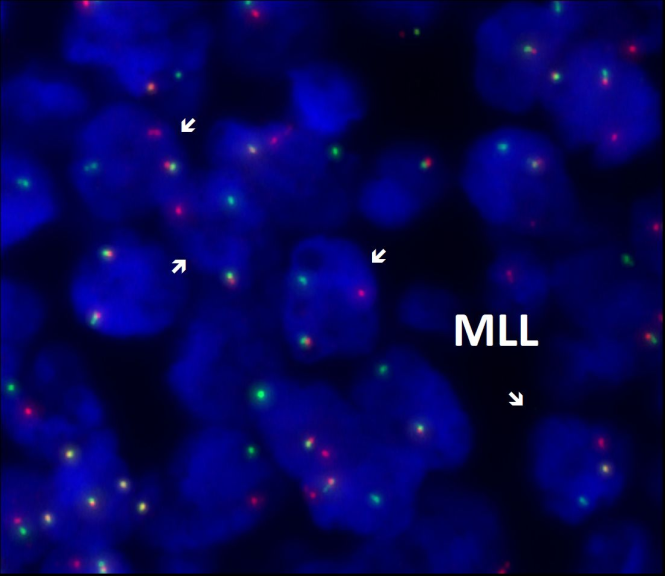
图一:应用 MLL 探针对此组织样本的细胞核进行 FISH 实验,MLL 位点的阳性重排信号比例高于正常对照组 4% 的阈值,提示阳性。
二、整合诊断(MDT)讨论
因为两个病理实验室及流式细胞免疫分型结果给出不同结论,我们通过高博诊断中心整合诊断平台组织了病例整合诊断讨论:
张永红主任:患儿年龄小,起病快,瘤灶进展迅速,应该是高侵袭性淋巴瘤。T 淋母多出现胸腔内占位,但是多发生于胸腺导致前纵隔占位,本患儿占位发生于一侧胸腔,延伸至背部及脊髓腔内,并且患儿病理为 B 淋母,不是 T 细胞表型。
关于成熟 B,包括伯基特、高级别 B 和弥漫大 B 均为高侵袭性成熟 B 细胞淋巴瘤,伯基特最多见,但是临床以腹部肿物及颌面肿物最常见,本患儿均不属于这两种类型的典型临床表现,临床表现不典型,病理及流式也均提示既有 B 淋巴母细胞的标记也有成熟 B 细胞标记,是否介于两者之间的类型?
由于 B 淋巴母和成熟 B 细胞淋巴瘤的起源及生物学特性不同,治疗方案也有很大的不同。诊断不明确,我们临床面临治疗方案选择困难,首选方案应该是诊断中倾向性更大的那个,所以提请各实验室主任及各位专家结合临床及各实验室结果讨论一下,给出最终诊断。
高博诊断中心流式细胞实验室喻新建主任:患儿流式免疫分型不表达 CD34、TdT 和 CD99 等幼稚标记,胞膜轻链限制性表达,不表达胞浆 IgM,是明确的成熟 B 细胞异常。但是流式结果与病理不一致。
查阅文献以往有过类似报道,发表在 Pediatr Blood Cancer 的一例报道与本病例相似,既有明确的成熟 B 标记又有 ML L 基因重排,作者认为诊断为「同时伴有成熟 B 标记及 MLL-AF9 的 B 淋巴母细胞淋巴瘤」。我们这例病人综合考虑可能诊断为 B 淋巴母细胞淋巴瘤比较合适。
高博诊断中心病理科高子芬教授:虽然病理免疫组化中 CD99 阳性、TDT 弱阳性,但是病人的流式细胞学提示为成熟标记,第二次病理加做 Kappa 部分也是阳性,结合形态考虑为弥漫大 B 细胞淋巴瘤,非特指型。
非生发中心 B 细胞起源 (Hans 模型)。但是基因结果提示伴 MLL-AF9 融合基因阳性;这个基因在母细胞多见,所以不能否定母细胞的诊断,病理诊断也要结合其他检查结果综合考虑,病理和其它检查结果不一致时要看病理和基因哪项检查在诊断中权重更大些。
病理科周春菊教授:肿瘤细胞小圆形,胞浆少、无空泡,核染色质均匀细腻,形态上与成熟 B 细胞的胞浆多空泡,核染色质多为颗粒状不同,且免疫组化中 CD20 仅少量表达,而 CD19 很好的表达,提示为 B 细胞分化早期的特点,CD99 阳性、TDT 弱阳性等母细胞标记阳性。
尽管流式免疫分型明确表达成熟 B 标记,但骨髓融合基因回报:MLL-AF9 融合基因阳性,而 MLL 基因更常见于母细胞淋巴瘤中,故而结合分子生物学更符合母细胞淋巴瘤的诊断,如果能完善表观遗传学的检查,则能更好的区分二者。
高博诊断中心分子实验室郑勤龙主任:患者分子检测检出 MLL-AF9 融合(即 KMT2A-MLLT3 融合);该融合主要见于 AML 患者,也在儿童 ALL 患者中检出,尤其在婴幼儿。
儿童 LBL 伴成熟 B 细胞表型患者存在 MLL-AF9 融合变异也有文献报道;有研究认为,携带 MLL-AF9 融合的造血干细胞变异在婴幼儿易于发生淋系或混合表型细胞肿瘤;分子生物学方面,基于 11q 染色体易位导致的 MLL(混合谱系白血病)基因重排的淋巴细胞肿瘤一般常发生在分化早期的淋巴细胞。
其免疫学表型的错位可能是由于携带 MLL-AF9 变异的肿瘤细胞发生分化时抗原表达紊乱所致,其本质被认为是 MLL 易位的早期淋巴细胞肿瘤。携带 MLL-AF9 融合的淋巴细胞肿瘤在 2020 年 NCCN《急性淋巴细胞白血病临床实践指南》和 2021 年 NCCN《儿童急性淋巴细胞白血病临床实践指南》中被认为预后不良。
经过各临床及实验室专家的联合会诊,检查结果提示为介于母细胞与成熟 B 细胞之间的类型,但是因为存在 MLL 基因,更倾向于母细胞的诊断,最终整合诊断为同时伴有成熟标记及 MLL-AF9 的 B 淋巴母细胞淋巴瘤/白血病,分期Ⅳ期 CNS2,入高危组。
按照 CNCL- NHL-2017-LBL 高危方案给 VDLP 治疗,D8 天外周血涂片:未见原始细胞,B 超:胸背部局部软组织约 3.3 cm××1.4 cm0.6 cm,最大瘤灶缩小了 97%,提示治疗敏感;D15 天骨髓涂片正常,骨髓 MRD:流式 0.38%,MLL-AF9 定量:0.21%;D33 天腹部 B 超、胸部核磁(图二)均未见活性瘤灶,骨髓 MRD:流式阴性,MLL-AF9 定量为 0,提示患儿达到分子水平缓解。
考虑到病人不是典型 B 淋母,有明确的成熟 B 标记,治疗应具有高剂量短疗程特点以防止进展,有脊髓占位则需加强中枢预防治疗,故后续继续给予一个 CAM 方案后提前 HR』-1,三疗程后中期评估 PET/CT(图三),骨髓 MRD 及脑脊液均为阴性,为 CR 状态。继续 HR2+HR3+HR1 巩固治疗及庇护所预防治疗后衔接异基因造血干细胞移植,顺利出仓。
至今移植后 1 年 3 月,已无病生存近 2 年。
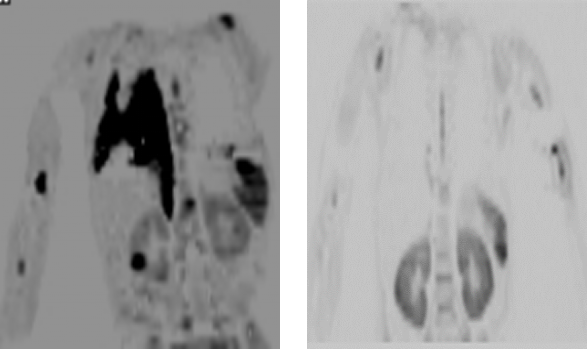
图二 MRI 病初后纵膈巨大占位及多发病变(左)MRI 诱导治疗 D33 瘤灶消失(右)
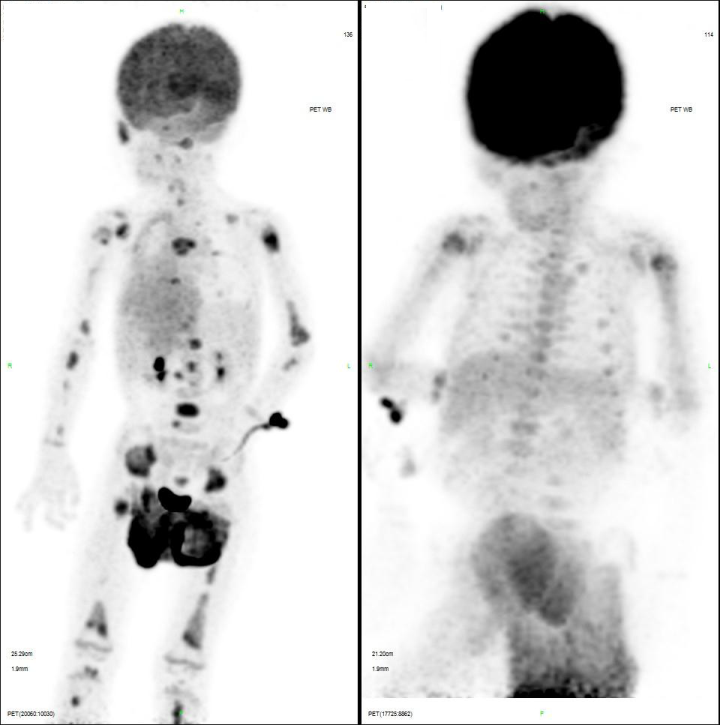
图三 治疗前 PET/CT(左)与治疗中期评估达 CR(右)
三、讨论
1. 病例特点:
⑴起病年龄小,⑵病灶广泛,瘤负荷巨大,以髓外病灶为主,累及胸腔、淋巴结、内脏、多发骨、骨髓及中枢。⑶MICM 分型特点为 FAB 分型为非 L3 型、免疫表型中 TDT、CD99 等母细胞标记弱表达,不表达髓系分化抗原,伴有 Kappa 和/或 Lambda 轻链的表达且伴有 MLL 重排,MLL-AF9 为阳性,不伴有 C-myc 断裂。
2. 发病情况及诊断相关难点:
这类成熟免疫表型非 L3 形态且伴 MLL 基因重排的 B 细胞淋巴瘤虽然少见,但随着免疫表型在大型研究逐渐被详细评估,越来越多的类似病例被报道。迄今为止,经文献检索已发现 27 例类似报道,国内除本例外,仅报道 1 例。患者发病年龄多小于 2 岁,成年人少见,MLL-AF9 阳性者居多,占 20 例。
由于它在形态学、分子生物学及免疫学方面兼具淋巴母细胞淋巴瘤与成熟 B 细胞淋巴瘤的特征,目前关于它的诊断尚有争议。
一方面,有的学者认为它具有明确的成熟 B 细胞的特征-限制性轻链的表达,且不少病例 TDT 不表达或弱表达,不符合母细胞淋巴瘤特点;虽然患儿年龄小且存在 MLL 重排,但多不表达髓系或自然杀伤细胞抗原,也不符合典型 MLL 阳性淋巴母细胞淋巴瘤/白血病的表型特点,把它看作是成熟 B 细胞淋巴瘤的一种特殊类型。
另外一方面,Irina Demina ed[1] 回顾既往经 MICM 确诊的 BL 和 BCP-ALL 的病例,发现一些合并 L3 型和 C-MYC 重排阳性的 Burkitt 淋巴瘤,sIg 表达阴性,其中一些甚至表达 TDT 或 CD34,这些病例早期曾被误诊为前 B 细胞淋巴瘤,这说明 B 细胞肿瘤表面轻链限制的存在与否,不能用来确定或排除成熟 B 细胞系的表型,所以当评估非典型的免疫表型时,应该从多学科的参数对肿瘤细胞系进行分析。
根据 WHO 的标准分类,非 L3 型的形态学以及 MLL 重排的细胞遗传学特征,均多见于母细胞来源的肿瘤;起病年龄偏小、肿瘤负荷高的临床特征也符合 MLL 阳性母细胞淋巴瘤/白血病的特点。
且有研究发现,MLL-AF9 阳性 B-ALL 中白血病启始细胞表型为 CD34-CD19+,而非 CD34+CD38+ CD19+,提示 MLL-AF9 阳性的肿瘤细胞可能来源于分化相对成熟的 B 系祖细胞 [2],由此推测原始分化相关的髓系或自然杀伤细胞抗原的表达,在 MLL-AF9 变异的患者中可能减少或缺失。
故而对于少见的或尚未清楚定义的病例类型,免疫表型在诊断中的权重不再占绝对优势,而需要强调 MICM 的整合诊断。
3. 治疗方案及疗效:
该疾病的治疗至今尚无统一的方案可供选择。我们回顾了 24 个病例的治疗和转归,17 例采用针对母细胞的早期化疗方案,15 例达 CR1(88%),10 例达 CCR(58.8%),中位生存时间为 22.7 月。采用成熟 B 细胞方案的患者有 7 例,100% 达到 CR1,仅 3 例达 CCR(42%),中位生存时间为 52 月。
可见,2 种方案的早期反应均敏感,但针对成熟 B 细胞淋巴瘤的方案相对母细胞方案复发率较高,提示针对母细胞的方案中,早期长疗程小剂量的诱导治疗较短疗程大剂量的高强度治疗,可能更有利于诱导母细胞分化成熟,后续因伴 MLL 基因而选择高危组巩固方案时,其大剂量短疗程多药联合的方案兼顾了克服成熟 B 细胞增殖快的特点,最大程度的降低微小残留病,减少早期复发的概率。
不同于成熟 B 细胞治疗方案,对于母细胞方案单纯化疗达持续缓解的这部分患者,可能也从诱导母细胞分化的漫长维持治疗中获益。
MLL 基因作为 pB-ALL/LBL 的高危因素,存在明确的异基因造血干细胞移植的指征。
回顾 22 个达 CR1 的患者,5 例直接序贯移植治疗后仅 1 例(20%)复发,而 CR1 后不序贯移植的 17 例患者中,9 例(53%)复发,提示针对具有表面限制性轻链表达和 MLL-AF9 阳性的 B 淋巴母细胞淋巴瘤/白血病,单纯化疗疗效差,易复发,序贯 allo-HSCT 可能改善预后,Sarashina[3] 建议 CR1 后即需要 HSCT,而不需要考虑 RT-PCR 监测 MLL-AF9 融合基因的 MRD 水平。
但需要指出的是,为减少移植后复发率,建议 CR1 后仍需要充分的巩固治疗和庇护所预防,当达到深度缓解的情况下再衔接异基因造血干细胞移植。
4. 发病机制探讨:
就像先前有学者把「过渡性 pB-ALL」描述为表达细胞质和细胞表面 IgM,但不表达限制性轻链的 pB-ALL 一样,认为这类病例中的肿瘤细胞起源于」过度前 B 细胞「和成熟 B 细胞之间的细胞中间体。
而事实上,Rina Kansal ed[4] 报道了 15 例具有典型前 B 细胞形态学、细胞遗传学改变的被确诊为 pB-ALL 的病例,它们除了表达前 B 细胞早期、中期和晚期的 B 细胞分化标记之外,同时都存在表面限制性轻链的表达,这说明 B 细胞肿瘤表面轻链限制的表达不局限于前 B 细胞晚期,而可能存在于前体 B 细胞成熟的早期、中期和晚期以及成熟 B 细胞的表面。
Bertrand[5] 等认为这一事实可能是由于未成熟白血病细胞中重组机制的异常表达,导致产生 V(D)J 重排导致。有研究发现不同的融合基因改变,即使仅基因断裂位点的不同,也可能随之产生细胞表型及生物学特征的改变,提示具有 ML-AF9 或者特殊基因的 pB-ALL,可能更容易出现特殊的免疫表型和生物学特性,而成为一种特殊类型的 MLL 阳性的 B 细胞淋巴瘤,这仍需继续探索。
小结
对于针对这类少见的 B 细胞淋巴瘤,首先要做完整的免疫分型,包括 TdT 和轻链的标记,如果免疫表型不典型,要进行整合诊断,当病理和流式分型结论不一致时,要分析细胞遗传及基因结果是否对具体病例的诊断具有更大的权重。
第二,对于既有幼稚 B 细胞标记,又有成熟 B 细胞标记的这类 B 细胞淋巴瘤患者,治疗上要选择兼顾二者的方案组合。
第三,有 MLL 重排并伴有成熟细胞标记的 B 淋巴母细胞淋巴瘤早期治疗反应虽好,但易复发,预后差,故建议早期治疗达缓解后,经过 3-4 个巩固及庇护所预防治疗达持续深度缓解后,尽早衔接异基因造血干细胞移植,改善预后。
参考文献:
1. Demina Irina,Zerkalenkova Elena,Illarionova Olga et al. Heterogeneity of childhood acute leukemia with mature B-cell immunophenotype.[J] .J Cancer Res Clin Oncol, 2019, 145: 2803-2811.
2. Aoki Yuki,Watanabe Takashi,Saito Yoriko et al. Identification of CD34+ and CD34- leukemia-initiating cells in MLL-rearranged human acute lymphoblastic leukemia.[J] .Blood, 2015, 125: 967-80.
3. Sarashina Takeo,Iwabuchi Haruko,Miyagawa Naoyuki et al. Hematopoietic stem cell transplantation for pediatric mature B-cell acute lymphoblastic leukemia with non-L3 morphology and MLL-AF9 gene fusion: three case reports and review of the literature.[J] .Int J Hematol, 2016, 104: 139-43.
4. Kansal Rina,Deeb George,Barcos Maurice et al. Precursor B lymphoblastic leukemia with surface light chain immunoglobulin restriction: a report of 15 patients.[J] .Am J Clin Pathol, 2004, 121: 512-25.
5. Bertrand F E,Vogtenhuber C,Shah N et al. Pro-B-cell to pre-B-cell development in B-lineage acute lymphoblastic leukemia expressing the MLL/AF4 fusion protein.[J] .Blood, 2001, 98: 3398-405.
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
好文章,需要你的鼓励
















