CD19 CAR-T 细胞治疗,在复发难治弥漫大 B 细胞淋巴瘤的治疗中已经产生了令人瞩目的疗效。随着国内外相应产品从临床试验走向真实世界,其疗效表现在真实世界中也得到了验证。国外报道的实际应用中,其总体缓解率达 73.6%,完全缓解率 56.1%,超越了所有其他挽救治疗方案。
然而,即便如此,依然有接近 60% 的接受了 CD19 CAR-T 细胞治疗的弥漫大 B 淋巴瘤患者面临治疗无效或缓解后再次复发进展。由于接受 CAR-T 治疗的患者,基本上是化疗时代复发难治的患者,因此一旦肿瘤再突破了 CAR-T 治疗这一所谓的「最后的防线」,后续治疗似乎已无路可循。这些越来越多的 CD19 CAR-T 治疗失败的患者,是否还能有希望获得治愈?
这里介绍一例 2 年前接诊的,CD19 CAR-T 及 CD22 CAR-T 治疗后失败的复发难治弥漫大 B 细胞淋巴瘤患者的挽救治疗过程及长期随访结果,为此类患者的治疗思路提供参考。
外院诊断及治疗
患者,男,35 岁,2 年 9 个月前(2019-08)无明显诱因出现右侧胸背部疼痛,持续性刺痛,夜间加重,伴夜间发热,体温 38℃ 左右,可自行降至正常,就诊当地医院行胸部 CT 检查,提示纵隔淋巴结肿大。上诉症状逐渐加重,给予消炎治疗,效果欠佳。随后 1 个月患者逐渐出现双下肢麻木,伴行走困难,胸椎核磁:胸 3-5 椎体平面椎管内脊髓外占位性病变,脊髓受压明显变形,给予脱水、B 族维生素营养神经,效果欠佳。进而出现双下肢无法活动,感觉消失,大小便失禁。转诊当地医院颅脑脊髓外科住院,于 9 月 18 日在全麻下行:椎管减压、胸椎椎管内肿瘤切除、胸椎钉棒系统内固定术。
术后病理提示:弥漫大 B 细胞淋巴瘤,非生发中心亚型,主要免疫组化:Bcl-2(+),Bcl-6(+),CD10(-),CD20(+),CD3(-),CD30(-),CD5(-),CD79a(+),c-myc(+),MUM1(+),P53(-),PAX-5(+),ki-67(90%+)。
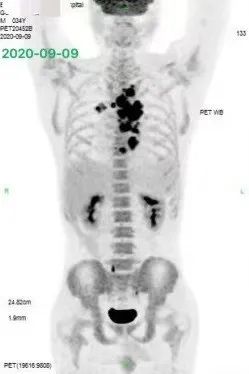
进一步完善 PET-CT:提示病灶累及胸椎、右上纵隔内、气管下段、左右主支气管周围、隆突下、右肺门多发淋巴结、胃小弯 (2.9 cm*2.6 cm)、右中下腹肠系膜多发淋巴结肿大伴代谢增高 (4.6 cm*3.7 cm);右侧闭孔内肌条等位置。临床分期 IVB 期。如下图 1:
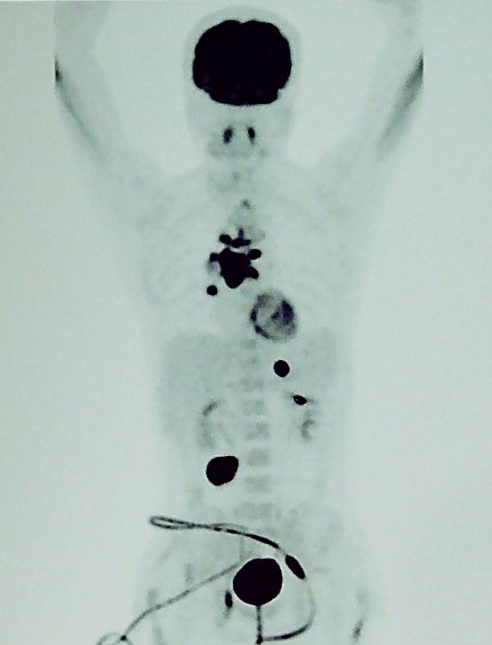
诊断明确后,患者立即开始接受化疗,前三个疗程采用了 R-CHOPE 为主的化疗,考虑到患者中枢神经系统受累及风险较高,中间加入了高剂量甲氨蝶呤 1 疗程进行中枢防控,同时还联合了来那度胺等靶向药物治疗,3 疗程后患者症状缓解,PET-CT 评估达到了部分缓解。进而患者继续接受了 3 疗程 R-CHOPE 及高剂量甲氨蝶呤的化疗。
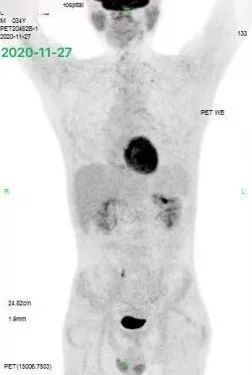
不幸的是,患者的疗效并没有进一步提高,反而在上述治疗后的 PET 评估中出现了疾病进展,如下图 2:
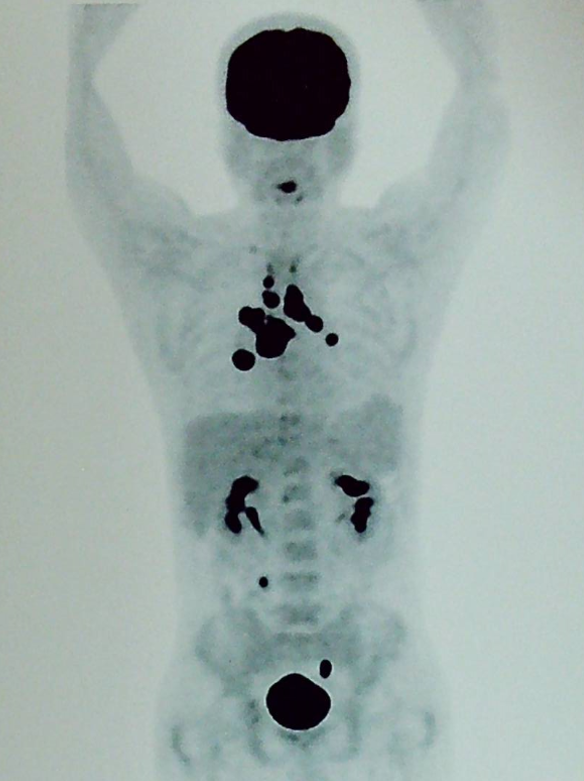
由于患者治疗中出现了进展,在当地参加了 CAR-T 细胞治疗的相关临床试验,在经过一疗程 R-CHOPE 方案桥接治疗及 FC 方案预处理后,患者于 2020 年 3 月接受了一次鼠源 CD19 CAR-T 细胞输注,输注后经历了 2 级 CRS 反应,随后在输注后 1 个月的早期评估 CT 中可见肿瘤明显缩小。
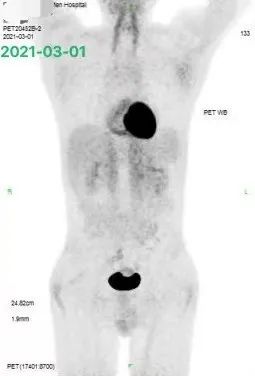
随后患者在 2020 年 4 月接受了 CD22 CAR-T 输注,作为序贯治疗。治疗后患者出现发热,胸闷,咳嗽以及间断的咯血。当地医院考虑 CRS 反应可能,给予相应的处理。CAR-T 细胞扩增情况具体不详。然而,在第二次 CD22 CAR-T 输注后的一个月,患者进行了 PET-CT 的评估,结果提示为肿瘤进展,如下图 3:
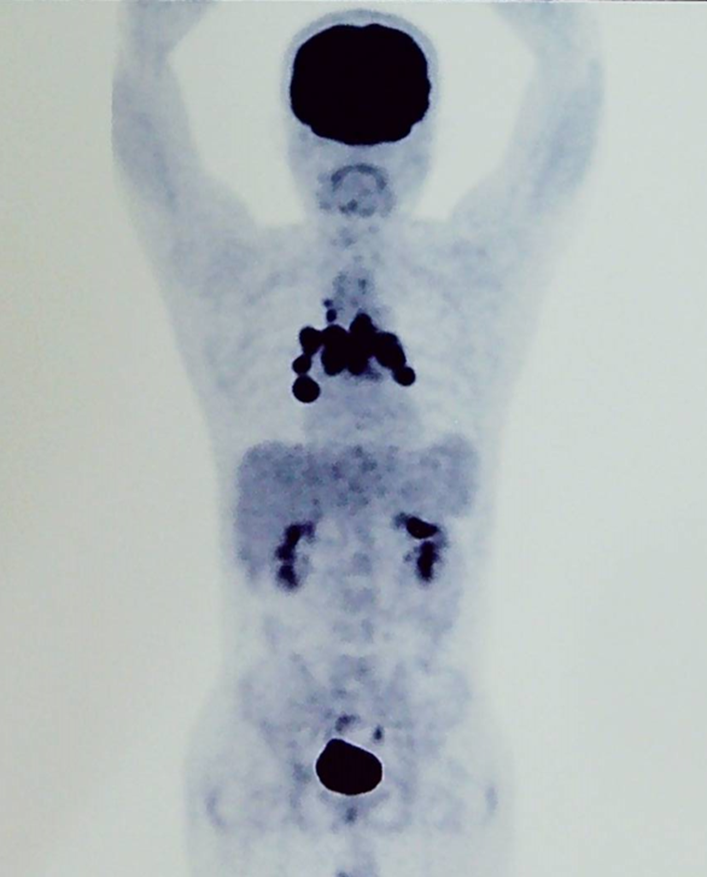
患者为求进一步治疗,转来我科。
入院情况
患者仍有间断发热,胸闷、咳嗽及咯血。伴双下肢无力及行走困难。
体格检查:体温:38.5℃;脉搏:113 次/min;呼吸:24 次/min;血压:130/80 mmHg。轮椅推入病房;全身浅表淋巴结未及,双肺呼吸音粗,可闻及散在细湿啰音。心腹部查体未见异常。下肢肌力 III-IV 级,病理征阴性。
血常规:白细胞 4.78*109/L;淋巴细胞计数 0.51*109/L;血红蛋白 119 g/L;血小板:99*109/L。
血生化:β2 微球蛋白 1.32 mg/L;乳酸脱氢酶 557 U/L;铁蛋白 757.6 ng/mL。
为了进一步了解患者肿瘤生物学特征,我们借取患者病理材料复习了病理结果,并进行了染色体 FISH 检查,肿瘤组织的二代基因测序,结果如下:
病理免疫组化:弥漫性大 B 细胞淋巴瘤,非特指型,非生发中心起源(Hans 模型),双重表达淋巴瘤;Bcl-2(80%+),Bcl-6(+),CD3(-),CD5(-),CD10(-),CD15(-),CD30(-),CD79a(NS),CD138(-),C-myc(热点 40%+),Ki-67(80%+),MUM1(+),PAX5(+)。CD20(+,95% 强),CD19(+,95% 强),CD22(+,95% 强),CD38(+,20% 弱),CD79a(+),P53(<5%+)。
基因二代测序:TP53、STAT3、TET2、CD79A、CHD8、NFKBIE、BCL10 突变。
FISH 检测:TP53 缺失阳性,BCL2 基因断裂(-),BCL6 基因断裂(+),MYC 基因断裂(-)。
入院诊断:复发难治弥漫大 B 细胞淋巴瘤,IVB 期;CD19 及 CD22 CAR-T 细胞治疗后。
思考:
本例患者是一例年轻高危的弥漫大 B 细胞淋巴瘤,起病时病情进展较快,累及部位比较广泛,并对脊髓产生了压迫。在前期化疗过程中,可以看到患者对 RCHOP 样的一线化疗方案并不敏感,从未达到过比较好的缓解,说明肿瘤具有原发的耐药倾向。后来患者经历了 2 次不同靶点的 CAR-T 治疗,短期疗效评估也不理想,后续治疗应该如何入手?
首先,目前来看针对一线治疗复发难治的年轻高危的弥漫大 B 细胞淋巴瘤患者,基本治疗策略还是采用含铂类的二线方案进行化疗,如果能达到比较好的缓解状态,后续可以考虑自体造血干细胞移植来强化巩固治疗,争取治愈。本例患者一线治疗疗效不佳,但是尚未尝试常用的二线治疗治疗,因此判断以标准二线化疗为基础的治疗可以尝试。
第二,患者基因上存在 TP53 突变,染色体检查提示 p53 缺失,或可解释患者的耐药倾向,结合患者其他基因异常,为了提高再次化疗的成功率,可以考虑联合靶向药物治疗。于是,我们开始了靶向联合二线化疗。
北京高博博仁医院治疗:
根据上述分析,考虑到患者一般状态较差,伴有反复发热、咳嗽、咯血的肺部表现,不能排除之前免疫治疗导致的肺损伤,而且患者肿瘤仍在进展,我们先行甲强龙治疗,清除了前期治疗的免疫反应。
一周后患者体温及咳嗽,咳血明显改善,但仍然较为虚弱,我们避免了高强度的二线化疗,而给予了 1 疗程减量的 GDP 方案为主的化疗,并根据患者基因检测的结果选择了联合了 Bcl-2 抑制剂和阿扎胞苷。
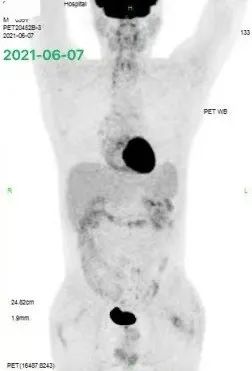
化疗后患者症状进一步缓解,于是我们按期再次给予上述方案化疗 1 疗程。2 疗程化疗后的 CT 评估,证实我们对患者化疗敏感性的推断,病灶有了明显的缩小,如下图 4:
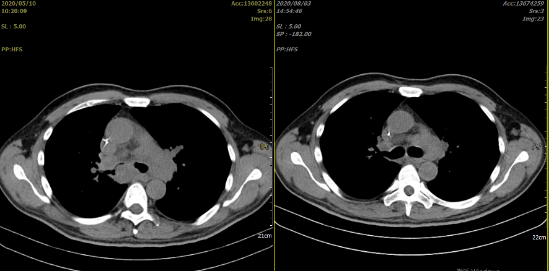
思考:
患者重新经过两个疗程的化疗,发现患者对化疗仍然有一定的敏感性,考虑患者后期可能仍具有接受自体造血干细胞移植的可能性,因此,在后续的治疗中我们准备找机会进行造血干细胞采集。
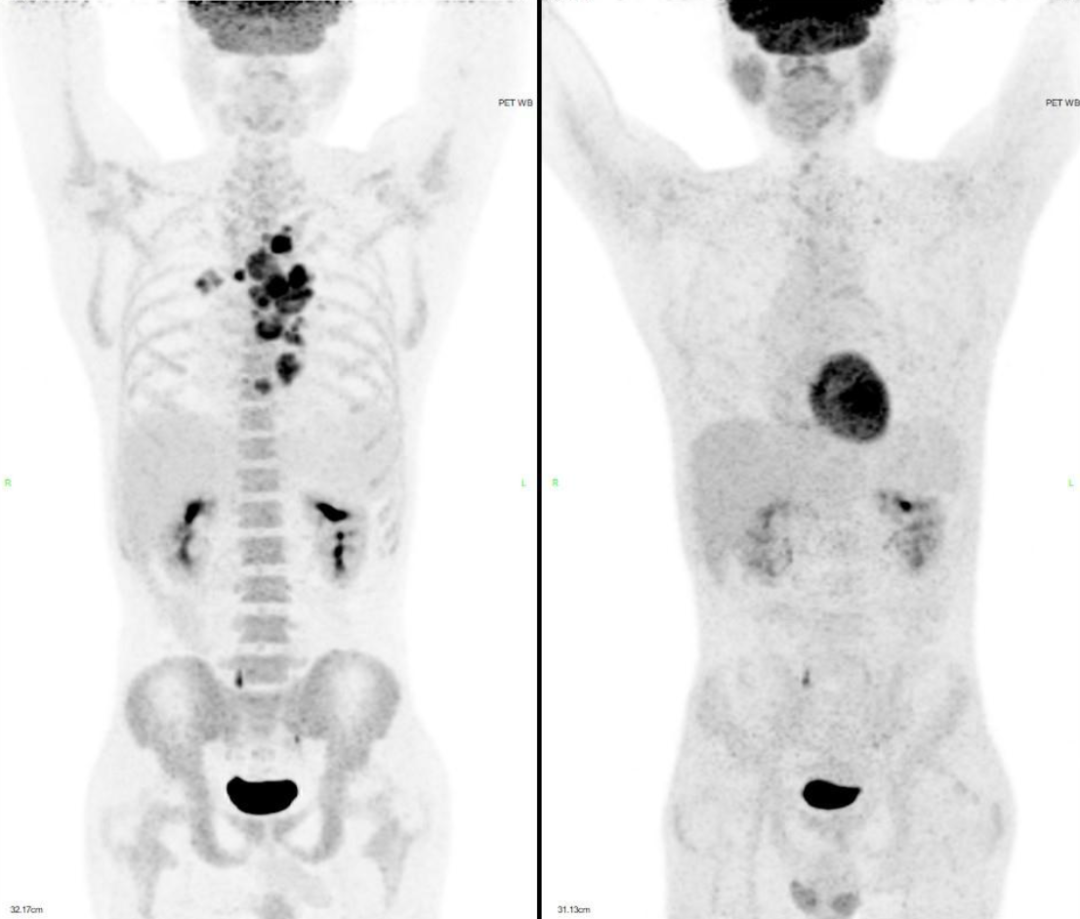
我们第 3 疗程继续采用 GDP 为核心的靶向化疗,并计划采集干细胞,动员采集过程顺利,获得造血干细胞:5.02×106/kg 。遗憾的是完成了干细胞采集后患者进行了 CT 评估,患者肿瘤似乎没有进一步消退,进一步 PET-CT 评价,虽然和治疗前相比能达到 PR,但仍有较多活性残留,如下图 5:
思考:
患者经历了二线方案化疗,虽然肿瘤得到了控制,但是残留病变较多。下一步治疗的一种选择是,再调整化疗方案或增加化疗强度,尝试再化疗,来争取更好的缓解状态。考虑到患者既往化疗疗程已达 10 疗程,而且存在 p53 缺失,整体来看标准剂量化疗或强烈化疗很难取得更好的疗效,而且对患者身体状态会产生严重的损伤,因此我们放弃了再次强烈化疗的尝试。
另一种选择是,已经达到 PR 状态,直接进行自体造血干细胞移植,以清髓的强烈化疗达到最大限度的杀伤肿瘤。但是,既往已有研究明确显示,在残留大量活性肿瘤的情况下,单纯的自体移植效果很差,后续短期的复发概率太高。因此,我们再次想到了 CAR-T 细胞治疗,尽管患者前两次 CAR-T 治疗效果不佳,但是都出现了 CAR-T 扩增和相应的 CRS 反应,并且出现过短期疗效,如果换用其他靶点和自体移植联合应用,二者产生的协同作用可能会有良好的疗效,这一点在文献和我们既往的经验中都得到过证实。
根据上述分析,在和家属及患者充分沟通,并取得同意后,我们制定了自体造血干细胞移植联合人源 CD20 CAR-T 细胞治疗的方案。
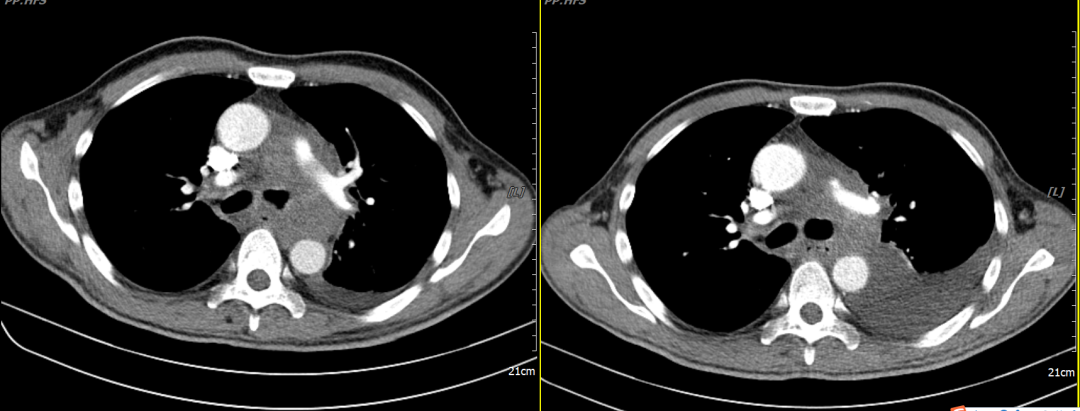
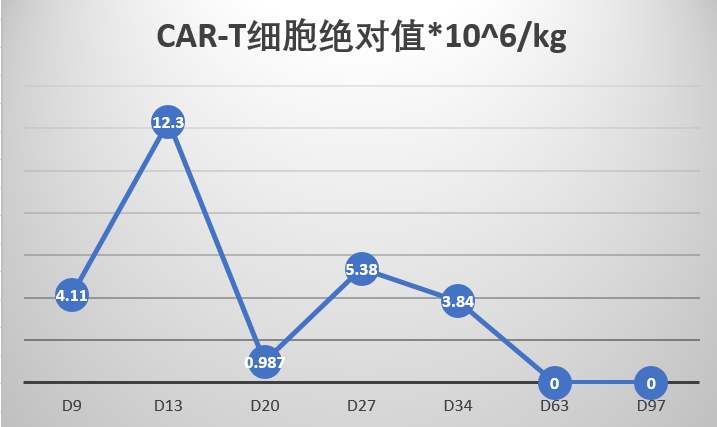
2020 年的 9 月 16 日,患者进入移植舱开始完成预处理化疗,过程顺利,随后回输自体造血干细胞,CD34+ 5.56*106/kg,干细胞回输后第二天输注自体人源 CD20 CAR-T 2.06*106/kg。随着 CAR-T 细胞的输注,患者出现了明显的细胞因子释放反应,持续发热伴有血氧一过性降低,低流量吸氧及标准 CRS 处理后,得到控制。最终 CRS 评级为 2 级,没有出现神经系统毒性。过程中监测 CAR-T 扩增情况,在 CAR-T 回输后的第 13 天,达到了扩增高峰,见图 8。移植后第 14 天,中性粒细胞及血小板植入,入移植舱后 27 天,患者顺利出仓。出仓后 CT 显示,后纵隔肿块明显缩小,但出现左侧胸腔积液,如下图 6:
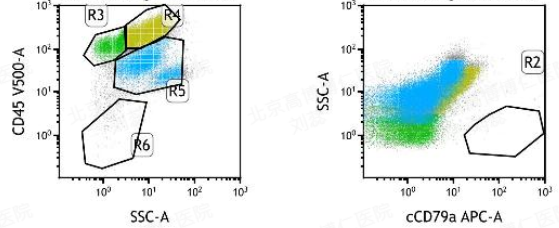
为了进一步排除肿瘤,我们对胸水进行了流式检测,采用 CD79a 圈门查找 B 细胞,未发现异常 B 细胞,如图 7。考虑胸水为反应性胸水,予以观察。
在患者完成自体移植联合 CAR-T 治疗后的 2 个月,终于迎来了首次 PET-CT 评估,结果达到了部分缓解,如下图 9:
考虑到患者既往 CAR-T 治疗后进展的病史,在移植后我们给予患者来那度胺进行维持治疗,并定期随访。令人惊喜的是,在随后观察的 1 年半中,患者肿瘤进一步缓解,最终达到完全缓解状态,患者下肢行走功能也完全恢复。随访 PET-CT 如下图 9:
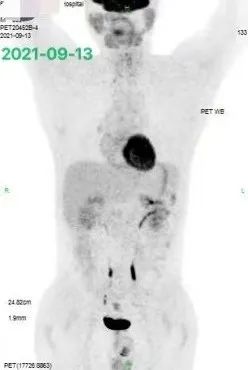
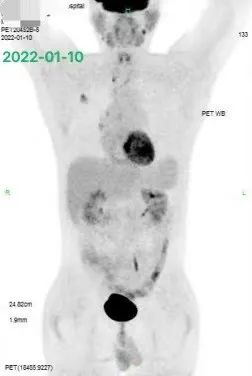
思考:
复发难治弥漫大 B 细胞淋巴瘤在不断发展的新技术治疗的情况下,一方面部分患者治疗效果和生存得到了很大的提高;另一方面,对多线化疗失败甚至是 CAR-T 细胞治疗失败的超难治患者也越来越多。
此类患者的治疗,首先应该是个体化的,第二应该是精准化的,第三应该是灵活的。本例患者前期治疗看似对化疗及 CAR-T 治疗都疗效不佳,而且具有 p53 缺失等高危因素,但是通过分析,在二线化疗方面还有值得尝试的空间,精准联合靶向药物治疗,控制了肿瘤进展的迅猛势头,并为干细胞采集提供了机会。
在本例患者的治疗中,根据每个阶段治疗的疗效,分析当时的具体情况,灵活安排下一步治疗策略,使恰当的治疗在恰当的时机应用。通过自体移植联合 CAR-T 细胞治疗的协同作用,尝试解决在肿瘤负荷较高的情况下自体移植容易复发的临床问题。这个尝试在本例患者中收效甚佳,也为未来此类患者提供了值得探索的方案。
专家介绍

好文章,需要你的鼓励
















