来源:《临床儿科杂志》
蒋文轩, 叶芳华, 肖逸心, 杨良春. 45 例噬血细胞综合征患儿的临床特点及预后分析 [J]. 临床儿科杂志, 2025, 43(10): 762-767 DOI:10.12372/jcp.2025.25e0216
JIANG Wenxuan, YE Fanghua, XIAO Yixin, YANG Liangchun. Analysis of clinical characteristics and prognostic factors of 45 children with hemophagocytic syndrome[J]. Journal of Clinical Pediatrics, 2025, 43(10): 762-767 DOI:10.12372/jcp.2025.25e0216
本文作者:蒋文轩 叶芳华 肖逸心 杨良春
作者单位:中南大学湘雅医院(湖南长沙 410008)
摘要:目的 分析儿童噬血细胞综合征(HPS)的临床特点及预后影响因素。方法 回顾性分析 2017 年 1 月至 2023 年 7 月收治的 45 例 HPS 患儿的临床资料及随访数据。结果 45 例患儿中位发病年龄为 4.5(2.1~10.0)岁,均以发热起病,感染相关 HPS 占 77.8%,其中 EB 病毒(EBV)感染最多(85.7%)。所有患儿总生存率(88.9±4.7)%。单因素分析显示三酰甘油 ≥ 3.8 mmol/L、乳酸脱氢酶 ≥ 2500U/L 是影响患儿预后的危险因素(P 均<0.05),多因素分析显示三酰甘油 ≥ 3.8 mmol/L 是影响患儿预后的独立危险因素(P= 0.029)。结论 HPS 常以发热起病,感染(尤其是 EBV 感染)为最常见的病因;初诊时三酰甘油及乳酸脱氢酶水平(尤其是三酰甘油 ≥ 3.8 mmol/L)是评估预后的关键因素。
关键词:噬血细胞综合征;临床特点;治疗;预后;儿童
噬血细胞综合征(hemophagocytic syndrome,HPS),又称噬血细胞性淋巴组织细胞增多症(hemo-phagocytic lymphohistiocytosis,HLH)是一种由遗传性或获得性免疫功能失常导致的过度炎症反应综合征,其临床症状并不具有特异性,可能由多种潜在因素引起,是一种进展迅速、致死率高的免疫过度活化综合征 [1]。随着对该疾病的不断认识,已有研究表明,初诊时一些实验室指标如血清铁蛋白水平在评估 HPS 的预后方面有重要参考价值,且国内外不少临床研究证明早期应用 HLH-2004 方案治疗后疾病得到了明显的改善。HPS 症状多种多样,初期如发热、皮疹等表现可能与其他疾病相似,某些实验室指标如血清铁蛋白水平升高、纤维蛋白原浓度降低等在其他炎症性疾病中也可能出现,从而导致临床医师容易误诊漏诊,若不能尽早确诊以及得到有效的治疗,病死率高达 50% 以上 [2]。通过对 45 例 HPS 患儿临床特征、实验室指标、治疗及预后情况进行回顾性分析,为优化 HPS 的诊断与治疗策略提供科学依据。
1 对象与方法
1.1 研究对象
收集 2017 年 1 月至 2023 年 7 月中南大学湘雅医院儿科诊治的 45 例 HPS 患儿,所有纳入患儿诊断年龄均 ≤ 18 岁,且符合国际组织细胞病协会 HLH-2004 诊断标准 [3]。
1.2 方法
1.2.1 资料收集 患儿的诊断年龄、性别、初诊临床表现、病因、辅助检查、治疗方法及预后等,回顾性分析患儿的临床特点与预后的相关性。
1.2.2 随访 通过门诊及电话回访对 45 例 HPS 患儿进行随访,随访截止日期为 2024 年 9 月 30 日。总生存时间(overall survival,OS)为患儿确诊至末次随访时间,或任何原因所致死亡的时间。
1.3 统计学分析
采用 SPSS 27.0 软件进行统计学分析,并绘制图形。正态分布计量资料采用均数±标准差(x±s)表示,组间比较采用 t 检验,非正态分布计量资料用中位数(四分位数范围)[M(P25~P75)] 表示,组间比较采用非参数检验。计数资料采用例数或百分率(%)表示,比较采用 χ2 检验。以 Kaplan-Meier 方法计算患儿的累积生存率,生存率的组间比较采用 log-rank 检验,并将单因素分析中 P<0.05 及其他可能影响预后(P 值接近 0.05)的因素纳入 Cox 比例风险回归模型进行多因素分析。以双侧 P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
45 例 HPS 患儿中,男女比例为 1∶1.05;中位发病年龄为 4.5(2.1~10.0)岁。全部患儿均以发热起病。常见体征包括脾大(75.6%),肝大(82.2%),淋巴结肿大(71.1%),部分患儿出现重要脏器的受累,如 27 例(60%)存在呼吸系统症状,7 例(15.6%)存在消化系统症状,分别各有 1 例(2.2%)出现泌尿系统累及(肾衰)和循环系统累及(心功能不全);27 例(60%)患儿存在多浆膜腔积液,5 例(11.1%)患儿存在中枢神经系统症状。
2.2 病因特征
45 例 HPS 患儿感染相关 35 例(77.8%),其中 EB 病毒(Epstein-Barr virus,EBV)感染占 85.7%,单纯腺病毒感染占 5.7%,单纯新冠病毒感染占 5.7%,腺病毒合并单纯疱疹病毒感染占 2.9%;肿瘤相关 4 例(8.8%),原发肿瘤均为淋巴瘤;风湿免疫相关 3 例(6.7%),其中 1 例患儿同时合并先天性免疫缺陷病。45 例患儿中有 15 例行基因检测,3 例确诊为家族性噬血细胞综合征(UNC13D 基因复合杂合突变 2 例、SH2D1A 半合子突变 1 例)。
2.3 治疗及转归
对于 13 例初诊时病情较轻的患儿,3 例单用激素、1 例单用免疫球蛋白(IVIG)、9 例采用激素+IVIG 治疗(其中 4 例患儿加用托珠单抗治疗,3 例风湿免疫相关性 HPS 联用环孢素);30 例存在加重风险的患儿接受 HLH-2004 方案化疗(家族性 2 例、EBV 相关 24 例、淋巴瘤相关 4 例),部分联合 IVIG 或血液净化,其中 1 例重症患儿加用利妥昔单抗及芦可替尼,2 例联合造血干细胞移植;1 例明确诊断家族性 HPS 患儿在外院行造血干细胞移植,1 例因个人原因要求转外院治疗。所有患儿若存在多种感染,同时给予抗感染等对症支持治疗。随访截至 2024 年 9 月 30 日,45 例患儿 5 年总生存率为(88.9±4.7)%,中位生存时间为 45.8(27.2~74.4)个月,总体生存曲线如图 1。2 例患儿于诊断后 28 天内死亡;1 例 2 个月内死亡,2 例复发死亡(5、9.6 个月)。HLH-2004 组患儿死亡 4 例(13.3%),存活 26 例(86.7%);非化疗组 13 例患儿均存活(100%),外院移植 1 例存活,转院 1 例死亡。
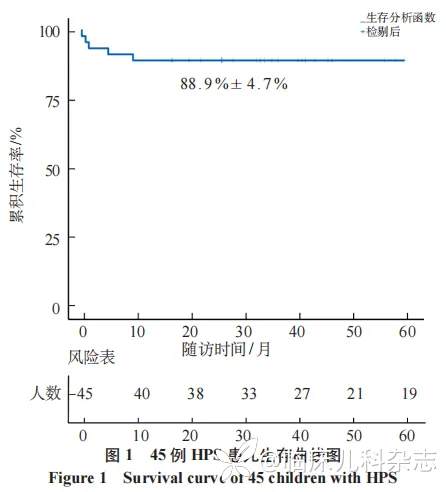
2.4 预后相关因素分析
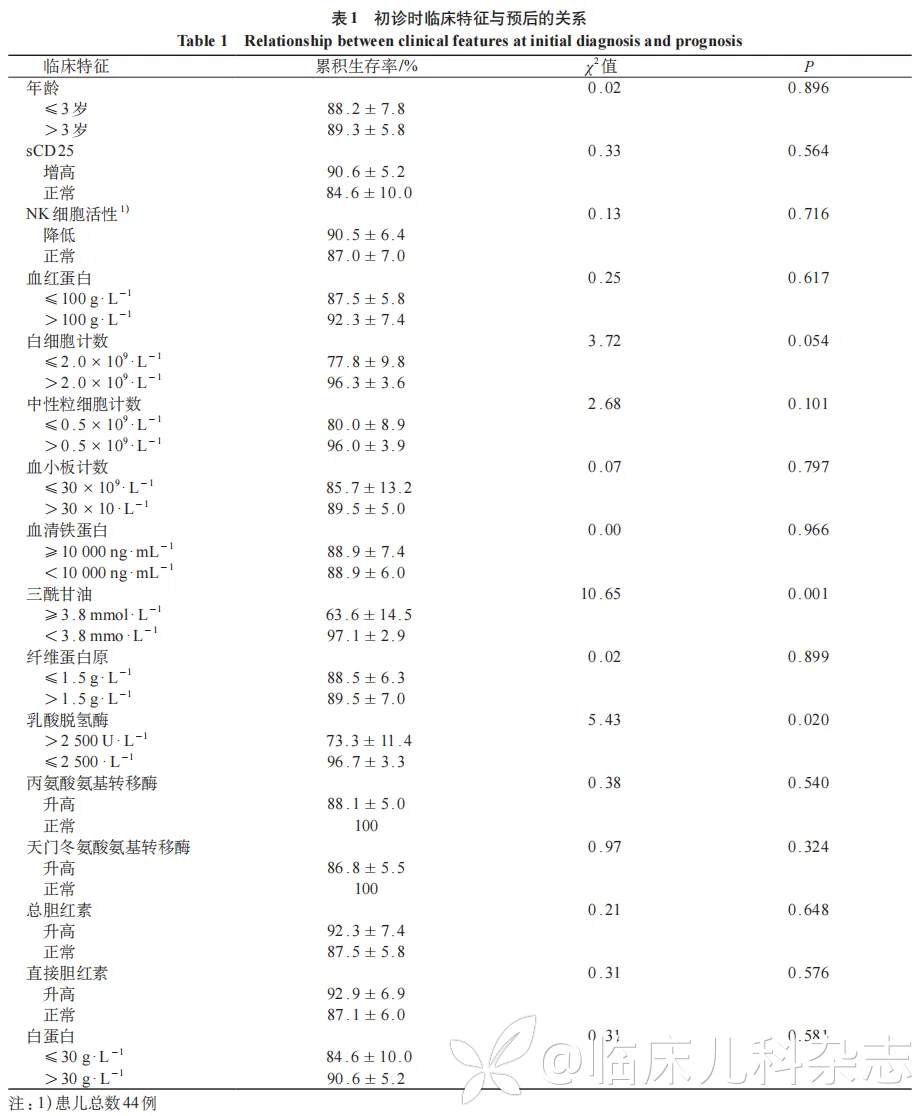
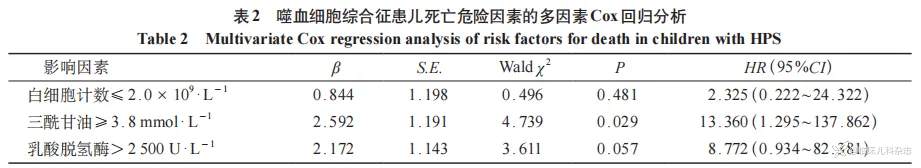
通过 Kaplan-Meier 生存曲线分析(图 1)及 log-rank 检验,针对 45 例 HPS 患儿的年龄分布及实验室检查进行预后因素相关分析,结果显示,三酰甘油 ≥ 3.8 mmol/L、乳酸脱氢酶 ≥ 2500U/L 是影响患儿预后的危险因素(P<0.05),见表 1;将单因素回归分析中 P<0.1 的指标纳入多因素 Cox 回归分析,结果显示,三酰甘油 ≥ 3.8 mmol/L 是影响患儿预后的独立危险因素(P= 0.029),见表 2。
3 讨论
HPS 是一种危及生命的全身性高炎症反应综合征,尽管发病率低,但其死亡风险极高,超过 10% 的患儿在确诊后 2 个月内死亡 [4-5]。据文献报道,HPS 多见于 2 岁及以下患儿,男性发病略占优势,而本研究的病例中,多见于 2~5 岁儿童,男女比例相当,与文献报道存在差异,可能与本研究中病例数少有关。
HPS 的临床表现多种多样,误诊率高达 60%,其核心症状包括但不限于发热、肝脾淋巴结肿大等。本研究中所有患儿起病时均表现发热症状,相当一部分患者存在消化系统表现、泌尿系统症状、循环系统症状,这提示,在临床实践中,若患儿持续发热,并合并肝脾、淋巴结肿大及消化、神经、呼吸等系统症状 [6],尽快评估各大系统功能,与具有类似临床特征的其他疾病鉴别,包括但不限于重症感染、朗格罕细胞组织细胞增生症等,以实现早期诊断并采取治疗措施。
继发性 HPS 的原因包括病毒、细菌、真菌感染,肿瘤及免疫相关疾病等 [3]。本研究的 45 例儿童 HPS 患儿,其统计结果表示,30 例为 EBV 感染性 HPS,占感染相关性 HPS 的 85.7%,占全部患儿的 66.7%,这说明 EBV 是最主要的病原体,与国外文献报道一致 [7]。有研究表明,EBV 通过在 B 细胞内潜伏感染,可影响骨髓微环境,造成免疫微环境失衡,影响骨髓造血 [8],同时,EBV 感染可致肝细胞受损 [9],间接影响纤维蛋白原的合成,使血小板计数和纤维蛋白原浓度进一步降低。原发性 HPS 是由于遗传基因异常导致,特定的基因突变使免疫细胞功能受到影响,穿孔素/颗粒酶作用途径受损,导致感染的靶细胞或抗原呈递细胞无法被有效地清除,引起免疫系统功能紊乱,最终导致疾病发生 [10-11]。既往也有关于 EBV-HPS 患者免疫状态的研究显示,该类患者的免疫功能缺陷,T 淋巴细胞亚群中各类型细胞计数存在异常 [12]。衡量机体免疫水平的参考指标包括 CD4+与 CD8+,若 CD4+/CD8+下降,则说明细胞免疫功能处于衰退状态,且 CD4+/CD8+下降,参与 EBV-HPS 患者病情进展 [13]。
对于病情较重的 HPS,目前广泛应用的标准治疗方案为 HLH-1994 方案和 HLH-2004 方案,即采用依托泊苷(etoposide,VP-16)、地塞米松(dexamethasone,Dex)[14] 联合或不联合环孢素 A(cyclosporine,CsA)治疗活动期 HPS,将疾病的缓解率从过去的不足 10% 提高到 70% 左右 [15],芦可替尼 [16] 等新型治疗药物,凭借其独特的药理机制以及显著的治疗效果,也驱动了这一领域治疗格局的革新。同时,有研究表明,EBV 主要在 HPS 患者的 B 淋巴细胞中复制 [17],而利妥昔单抗能有效地针对 HPS 患者的 B 淋巴细胞进行杀伤;日本专家对 42 例使用利妥昔单抗的 EBV-HPS 患者进行统计分析发现,传统化疗联合利妥昔单抗能显著改善 HLH 患者的症状、减少病毒载量和降低炎性因子水平,且对储存 HPS-EBV 的 T-淋巴细胞和 NK 细胞也可以起到良好的抑制和杀伤效果 [18]。此外,白介素 6 以及白介素 8 主要来源于单核巨噬细胞这类细胞中,两者对 T 淋巴细胞的趋化和激活都有很强的作用,即在机体的免疫调节、炎症反应和造血调控中均发挥着积极的促进作用 [19],与 HPS 发病机制相符。所以,托珠单抗(Tocilizumab) 作为一种特异性针对 IL-6 受体的单克隆抗体,其作用在于精确调控 HPS 的「细胞因子风暴」,可作为 HPS 治疗策略中有前景的选择之一 [20]。本研究中患儿的治疗方案主要根据其不同病因及严重程度采取对应治疗。单用激素或者 IVIG、或二者均使用并联合托珠单抗、CsA 治疗共 13 例患儿,存活率 100%,尤其是风湿免疫相关性 HPS[21],联用托珠单抗及环孢素治疗后缓解率较高。1 例患儿在化疗基础上联用了利妥昔单抗及芦可替尼,但结局仍为死亡,可能与其起病后诊断时间较晚、症状已进行性加重有关。总体而言,45 例 HPS 患儿经治疗后临床症状逐渐缓解,5 年总生存率为 88.9%,利妥昔单抗仍是值得进一步探究的免疫治疗方向。
Tang 等 [22] 研究表明,乳酸脱氢酶水平升高是 HLH 患儿的不良预后因素。研究表明三酰甘油升高是 0~6 岁儿童 HPS 预后的独立影响因素 [23-24],赖东波等 [25] 指出三酰甘油 ≥ 4.0 mmol/L 是造成 HPS 患儿死亡的独立危险因素。本研究发现,高三酰甘油血症、乳酸脱氢酶水平高是影响 HPS 预后的重要因素,单因素分析结果显示乳酸脱氢酶>2500U/L、三酰甘油 ≥ 3.8 mmol/L 是 HPS 患儿预后不良的危险因素,多因素分析显示三酰甘油 ≥ 3.8 mmol/L 为影响 HPS 患儿的独立危险因素,这与上述文献报道结果一致。从疾病本质来看,HPS 的发生主要源于一场「炎症因子风暴」,炎症因子可通过刺激肝脏生成、抑制外周清除三酰甘油,从而导致三酰甘油水平的升高,同时,三酰甘油也可激活单核/巨噬细胞等免疫细胞分泌更多的炎症因子,此双向作用可用来监测疾病的活跃度。此外,乳酸脱氢酶是一项重要的肿瘤标志物,其水平的升高常提示肿瘤细胞的增殖活跃,在本研究的 4 例肿瘤相关的 HPS 患儿中 3 例患儿乳酸脱氢酶>2500U/L,原发疾病均为淋巴瘤,预后均为存活,考虑 LDH 升高与预后相关这一结论与肿瘤并不存在相关性。
总的来说,儿童 HPS 应根据临床特点、病情进展情况、药物反应等多方面进行综合分析,适时监测和评估病情,不断调整治疗方案。而儿童作为正处于生长发育中的特殊群体,其对药物的剂量及安全性方面有着更为特定的需求。因此,我们在治疗过程中应注重个体化治疗,以更好地提高疗效。
好文章,需要你的鼓励
















