来源:《临床儿科杂志》
李勇, 周利娟, 范立, 吴峤微, 曹梅, 程真梅, 朱曦, 诸澎伟, 吴波. 9 例肺移植儿童术后住院诊疗情况与随访分析 [J]. 临床儿科杂志, 2025, 43(4): 286-292 DOI:10.12372/jcp.2025.24e0624
LI Yong, ZHOU Lijuan, FAN Li, WU Qiaowei, CAO Mei, CHENG Zhenmei, ZHU Xi, ZHU Pengwei, WU Bo. Analysis of diagnosis and treatment in hospital and follow-up in 9 children after lung transplantation[J]. Journal of Clinical Pediatrics, 2025, 43(4): 286-292 DOI:10.12372/jcp.2025. 24e0624
本文作者:李 勇 1 周利娟 1 范 立 2 吴峤微 1 曹 梅 1 程真梅 1 朱 曦 1 诸澎伟 1 吴 波 2
作者单位:1. 江南大学附属无锡市儿童医院儿童重症监护室(江苏无锡 214023);2. 江南大学附属无锡市人民医院肺移植中心(江苏无锡 214023)
摘要:目的 总结 9 例肺移植儿童的临床特点,探讨肺移植儿童的预后及免疫状况,为临床诊治提供参考。方法 回顾性分析 2019 年 1 月至 2023 年 6 月在我院住院诊治的 9 例肺移植患儿的临床资料及预后情况。结果 9 例患儿,男 3 例、女 6 例。基础病包括肺纤维化、特发性肺动脉高压、闭塞性细支气管炎、肺间质病变及肺囊性纤维化。所有患儿均为双肺移植,肺移植年龄 7.83(4.79~9.34)岁。4 例患儿发生支气管狭窄,其中 3 例为<7 岁患儿,且 2 例诊断为慢性移植肺功能障碍相关闭塞性细支气管炎综合征(BOS)。与正常参考值比较,6 例患儿 CD3+T、CD8+T 细胞比例增高,4 例 CD4+T 细胞比例、8 例 CD4+T/CD8+T 降低, <7 岁患儿免疫异常更为显著。2 例 BOS 患儿均出现移植后淋巴组织增生性疾病(PTLD),均经活检诊断为弥漫大 B 细胞淋巴瘤。随访 2.67(1.67~3.17)年,2 例 BOS 患儿分别于移植后 1.33 年、1 年死亡,均死于Ⅱ型呼吸衰竭。>7 岁患儿均居家口服免疫抑制药物,可进行简单体力活动及日常生活。结论 BOS、PTLD 是<7 岁双肺移植儿童危及生命的并发症,与 T 淋巴细胞亚群异常密切相关。低年龄儿童肺移植后生存期短,其肺部结构和免疫状况是影响预后的关键因素。随着肺移植儿童数量的增加,需进一步扩大病例数量及深化年龄分组研究,以优化临床诊治策略,延长患儿生存期并提高生活质量。
关键词: 肺移植; 儿童; 免疫状况; 预后
肺组织病变进展到无法完成氧合和通气功能时,肺疾病进入终末期,肺移植是仅有的治疗方法。目前肺移植技术日趋成熟,全世界每年有 100 多例儿童进行肺移植 [1]。关于移植后患儿的远期并发症及免疫状况报道较少。本研究对 9 例肺移植儿童的临床资料进行回顾性分析,旨在为肺移植患儿的诊治提供参考。
1 对象与方法
1.1 研究对象
对 2019 年 1 月至 2023 年 6 月在无锡市儿童医院住院诊治的 9 例肺移植患儿进行回顾性分析,患儿年龄 1 月龄~18 岁,均肺移植成功。
1.2 临床资料
收集患儿相关临床资料,包括性别、基础病情况、肺移植日期、肺移植年龄、肺移植方式、住院体重;肺部、腹部 64 排螺旋 CT 检查结果;纤维支气管镜(Olympus BF-P290)检查结果;肺功能检查结果;淋巴细胞计数、淋巴细胞亚群比例;免疫抑制剂使用情况;慢性移植肺功能障碍相关闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)、呼吸衰竭、移植后淋巴组织增生性疾病(posttransplant lymphoproliferative disorder,PTLD)发病情况;病原学检测结果;最高儿童死亡危险度评分(pediatric risk of mortality Ⅲ,PRISM Ⅲ)[2]、入住 PICU 天数、预后等资料。纤维支气管镜诊断标准 [3]:气管支气管管腔内径缩小,直径缩小 ≥ 50% 为气管支气管狭窄。PRISM Ⅲ分数越高,病情越危重,死亡风险越高,≥ 10 分为危重。
1.3 淋巴细胞亚群检测
采集 2 mL 患儿静脉血,按说明书标准流程操作(试剂及抗体均购自美国 BD 公司),Beckman-Coulter 流式细胞仪检测 T 淋巴细胞亚群。参考值取不同年龄正常人群外周血淋巴细胞亚群参考值 [5]。
1.4 治疗及随访
护理、吸氧、无创呼吸支持、有创呼吸支持、排痰、俯卧位、抗感染、免疫支持、营养支持、降肺动脉压力、脏器功能支持、抑制免疫、化疗、放疗、稳定内环境等。出院后电话随访患儿家长,记录患儿预后状况。
1.5 统计学分析
采用 SPSS 27.0 统计软件进行数据分析,非正态资料以中位数 M(P25~P75) 表示。
2 结果
2.1 一般资料
9 例患儿中基础病包括肺纤维化 4 例,特发性肺动脉高压 1 例,BOS 2 例,肺间质病变 1 例,肺囊性纤维化 2 例,1 例患儿同时患有肺纤维化和 BOS。基础病诊断年龄 5.00(1.25~6.09)岁,肺移植年龄 7.83(4.79~9.34)岁,住院体重 25(14~29)kg。9 例患儿均为双肺移植,4 例患儿发生支气管狭窄,<7 岁患儿 3 例,均发生支气管狭窄,其中 2 例肺功能显示周边呼吸道阻力增加,诊断 BOS4。与 T 淋巴细胞参考值比较,6 例 CD3+T、6 例 CD8+T 细胞比例增高,4 例 CD4+T 细胞比例、8 例 CD4+T/CD8+T 降低,3 例<7 岁患儿 CD8+T 细胞比例均增高,CD4+T 细胞比例、CD4+T/CD8+T 均降低,其中 1 例呼吸、神经、血液系统分区检测出 Epstein-Barr 病毒 (EBV),1 例血液系统检测出 EBV。3 例<7 岁患儿入住儿童重症监护室(PICU),2 例 BOS 患儿使用呼吸机并在 PICU 分别于移植后 1.33 年、1 年死亡,均死于Ⅱ型呼吸衰竭。1 例好转出院;6 例>7 岁患儿均入住儿童呼吸科病房,好转出院。患儿 PRISMⅢ为 9.00(7.50~17.50)分。随访 2.67(1.67~3.17)年,电话随访>7 岁患儿均居家口服免疫抑制药物,可进行简单体力活动及日常生活。见表 1。
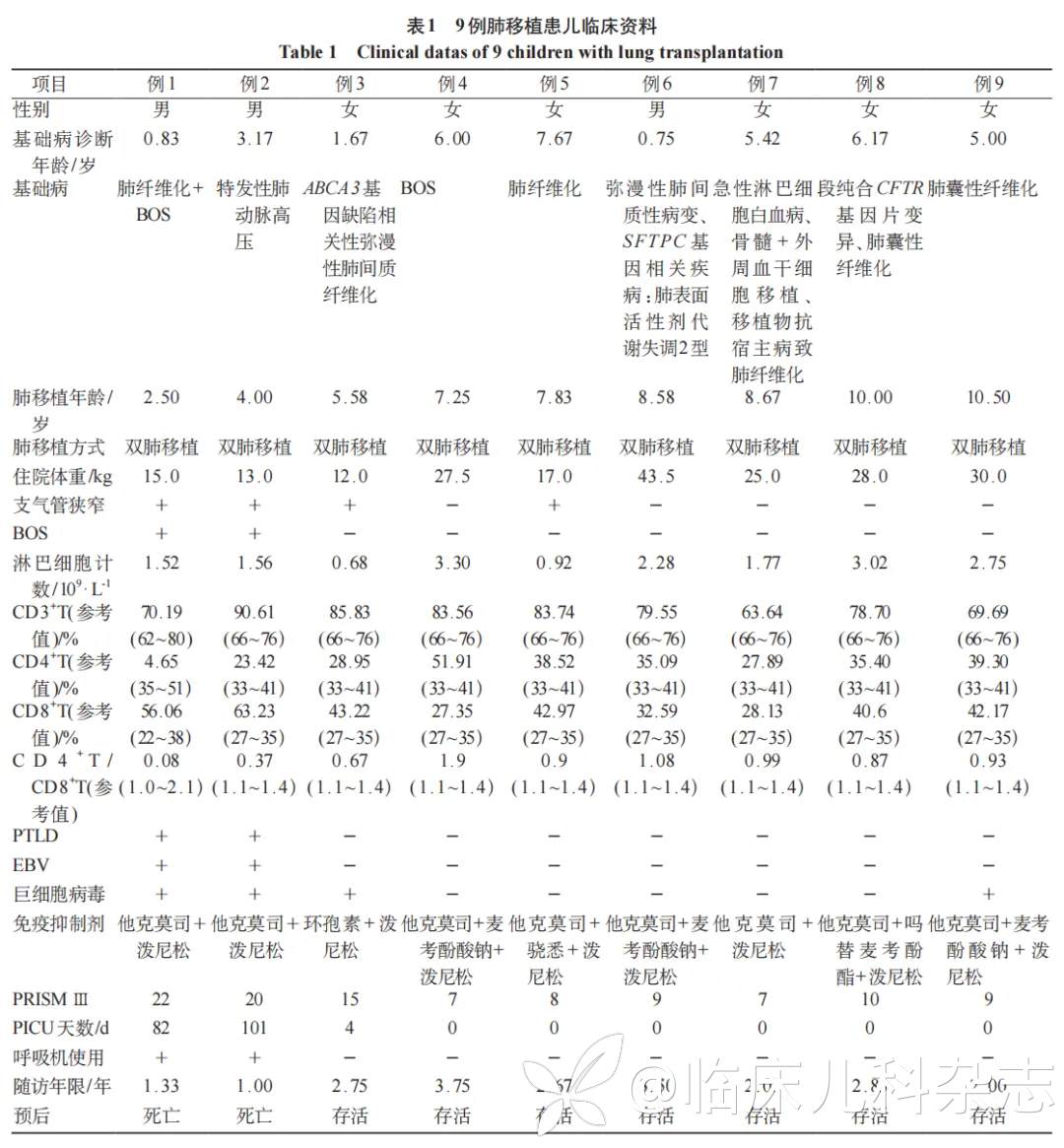
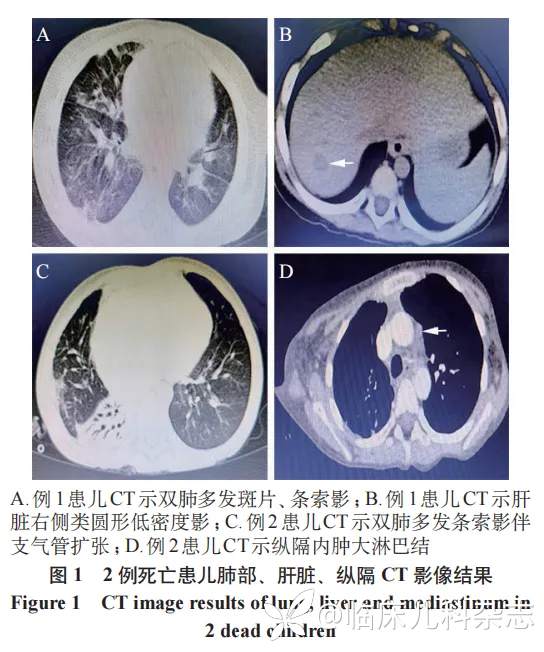
2.2 死亡患儿临床资料
2 例死亡患儿均诊断 BOS,均出现 PTLD,1 例因 CT 显示肝脏右侧类圆形低密度影,有 EBV 感染,行肝脏穿刺活检病理诊断单一型 PTLD(弥漫大 B 细胞淋巴瘤);1 例因腹部彩超示肝脾大,CT 示纵隔、腹部淋巴结肿大,有 EBV 感染,行骨髓穿刺、胸腔镜淋巴结活检病理诊断 PTLD(弥漫大 B 细胞淋巴瘤)。见图 1。
2.3 术后住院诊疗资料
在本研究中,<7 岁的肺移植患儿术后住院期间的诊疗情况。
1 例患儿在肺移植术后共入住 PICU 5 次,儿童呼吸科 3 次。在术后随访期间,患儿出现多系统并发症,共 6 个系统,总计 16 种并发症。具体包括:呼吸系统有 BOS、Ⅱ型呼吸衰竭;循环系统有肺动脉高压、左心衰竭;神经系统有昏迷、中毒性脑病、轻度脑萎缩、脑干损伤;消化系统有口腔炎、胃肠炎、消化道出血;血液系统有粒细胞缺乏;内分泌系统有甲状腺功能低下、皮质醇不足;代谢紊乱有低钠血症、低钾血症。针对上述并发症,患儿接受了包括抗细菌、抗肺炎支原体、抗病毒、抗真菌、免疫调节、降肺动脉压力、化疗、抗惊厥等在内的综合治疗。然而,尽管进行了积极的治疗,患儿仍有呼吸困难的症状,且长期卧床,无法出院。
1 例患儿在肺移植术后入住 PICU 4 次,儿童肾内科 2 次。并发症涉及 5 个系统,总计 12 种,包括:呼吸系统有 BOS、Ⅱ型呼吸衰竭;循环系统有肺动脉高压、右心衰竭;消化系统有肝功能损伤;泌尿系统有肾功能不全;血液系统有嗜血细胞综合征;代谢紊乱有低蛋白血症、高血糖、低钾血症、低镁血症、高脂血症。该患儿接受了抗细菌、抗肺炎支原体、抗病毒、抗真菌、减轻心脏负荷、降肺动脉压力、化疗、免疫调节等治疗措施。但仍有呼吸困难、气喘的症状,且无法出院。
1 例患儿在肺移植术后入住 PICU 1 次。患儿出现 3 个系统,总计 6 种的并发症:呼吸系统有肺炎、慢性呼吸衰竭;循环系统有肺动脉高压、慢性肺源性心脏病;神经系统有非创伤性颅内出血。代谢紊乱有重度营养不良。在治疗过程中,患儿接受了抗细菌、抗病毒、抗真菌、保护胃黏膜、人血白蛋白等治疗措施。经过治疗,患儿的咳嗽、气喘症状有所好转,并最终出院。
对于>7 岁的肺移植患儿,术后均入住儿童呼吸科 1 次。1 例出现大叶性肺炎、中度贫血、双侧胸腔积液;1 例出现支气管肺炎、严重营养不良、轻度贫血 ;1 例出现支气管肺炎 ;1 例出现急性支气管炎、胃肠功能紊乱;1 例出现霉菌性上颌窦炎;1 例出现急性上呼吸道感染,经抗感染及对症治疗后均康复出院。
3 讨论
肺是机体进行气体交换、维持呼吸功能的关键器官,同时也是容易发生病变的部位。当肺纤维化、BOS、特发性肺动脉高压、肺囊性纤维化、特发性肺间质疾病、α-l-抗蛋白酶缺乏症等疾病进展恶化,各种代偿与干预无法维持呼吸功能时,肺功能进入终末期,此时肺移植成为挽救终末期肺病患者生命的唯一手段 [5]。近年来,中国肺移植儿童数量呈现逐渐增加的趋势,但由于经济、社会、移植条件等诸多因素的限制,其数量仍少于成人 [6]。尽管儿童肺移植已有较多报道,但关于移植后患儿远期并发症及免疫状况的研究相对较少。本研究通过回顾性分析在我院住院诊治的 9 例肺移植患儿的临床资料,旨在探讨其远期并发症及免疫状况,为肺移植患儿的诊治提供参考依据。
双肺移植是目前主要的肺移植方式,然而其与明显的心肺水肿、肺缺血、原发性移植物功能障碍等并发症相关,且可能增加死亡率 [7]。Mazzetla 等 [8] 研究发现,在存活>3 个月的 161 例双侧肺移植患者中,22 例(13.6%)发生了支气管狭窄,支气管狭窄与多种因素相关,包括支气管缺血、供/受体大小不匹配、灌注不足、供体器官保存不良、机械通气、原发性移植物功能障碍、免疫抑制和手术等 [10],且与肺部感染相互恶化。支气管狭窄通常在肺移植后最初的 2 到 9 个月内发生,肺功能检查显示,无支气管狭窄的患儿中 18% 发生了 BOS,而有支气管狭窄的患儿中这一比例高达 27%[8],BOS 是同种异体移植肺功能障碍最常见的形式,BOS 使肺移植患儿中位生存期仅为 5.7 年 [10-11],且与移植后患儿的病情严重程度、PICU 入住天数相关。然而,关于双肺移植后支气管狭窄及 BOS 发生率在年龄上的分布,目前尚缺乏进一步研究。
有研究回顾性分析了 117 例首次接受肺移植的<18 岁患儿,分为<12 岁儿童组和青少年组,结果显示两组 72 小时原发性移植物功能障碍 3 级,院内死亡率、移植肺存活率和无慢性同种异体移植肺功能障碍的 8 年随访结果没有差异 [12]。Otani 等 [13] 研究发现<7 岁儿童比>7 岁儿童具有更高的死亡率和移植物功能障碍风险。研究中 9 例患儿均为双肺整体移植,其中 4 例发生支气管狭窄,3 例<7 岁肺移植患儿均存在支气管狭窄,且其中 2 例患儿出现 BOS、PTLD,最终均死亡。这些患儿病情危重、并发症多、治疗困难,PICU 住院时间长,与本研究结果一致。这种现象的原因是多方面的,主要原因<7 岁儿童各系统器官尚未成熟,其器官结构、功能易受各种因素影响而发生变化,例如幼儿肺移植支气管吻合术后发生支气管狭窄的风险更高 [14]。此外,是 7 岁儿童的医学诊断和治疗具有挑战性,评估手术指征和术后并发症风险较为困难,且由于表达障碍,不能充分评估其他功能状态和生活质量,这也是儿童年龄与成熟度成为肺移植考虑因素的原因 [13,15]。
细胞免疫在肺移植排异反应中起重要作用,既往观点一致认为 CD4+T 与 CD8+T 细胞协同促进受体对移植物的排斥反应 [16]。外周血 CD3+T、CD8+T 细胞升高与肺移植后气道结构破坏有关 [17],在 BOS 的发病机制中至关重要。有研究发现严重肺实质破坏性疾病患者也出现外周血 CD3+T、CD8+T 细胞升高,CD4+T 细胞、CD4+T/CD8+T 降低的现象 [18-19]。既往认为,外周血、肺泡灌洗液、肺组织 T 淋巴细胞状况并不一致,并且外周血的数据不能反映同种异体移植肺组织的状况。鉴于肺组织活检的执行难度,肺泡灌洗液成了研究首选,一些研究证实,与稳定肺移植受者相比,肺移植后 BOS 患者的肺泡灌洗液中 CD3+T 细胞比例没有显著差异 [20-21],研究显示 CD8+T 细胞比例增加,CD4+T 细胞比例减少 [22],一项研究得出了 BOS 患者 CD4+T 细胞比例增加和 CD8+T 细胞比例减少的相反结果 [20],另一项研究则无法证明两者之间的差异 [21]。此外,一部分研究使用支气管内膜活检,发现肺移植后 BOS 患者肺组织 CD3+T 和 CD8+T 细胞增加,与稳定肺移植受者相比,BOS 患者 CD8+T 细胞浸润更多 [23]。有研究证实肺移植患者外周血 CD4+T 和 CD8+T 主要淋巴细胞亚群状况与肺泡灌洗液呈正相关,这表明监测血液中的 T 细胞亚群可以间接了解移植肺 T 细胞的组成,并为肺泡灌洗检查甚至肺活检提供指示 [24]。外周血 CD4+T 细胞、CD4+T/CD8+T 降低提示免疫功能低下,与肺移植后恶性肿瘤的发生有关,因为抗肿瘤需要细胞免疫,而 PTLD 是肺移植患儿死亡相关的肿瘤性疾病,与 T 细胞免疫监视功能低下密切相关 [25-26]。目前,关于肺移植后 T 细胞亚群的变化的研究以成人纵向研究为主 [27-28],不同年龄人群的差异尤其不同年龄儿童之间的 T 细胞亚群差异研究较少,在发生严重移植肺功能障碍及肿瘤并发症的患儿中研究更少。本研究采用外周血淋巴细胞亚群研究 T 细胞状况,与参考值比较,9 例患儿中发现 6 例 CD3+T、6 例 CD8+T 细胞比例增高,4 例 CD4+T 细胞比例、8 例 CD4+T/CD8+T 降低,3 例<7 岁患儿的 CD8+T 细胞比例均增高,CD4+T 细胞比例、CD4+T/CD8+T 均降低,说明 T 细胞参与了肺移植后患儿 BOS、PTLD 的发生,且发现<7 岁患儿 T 细胞异常更容易发生,这可能与小儿免疫系统未接触各种抗原,更易受异体抗原、免疫抑制剂、感染等外界因素影响而发生明显改变有关,这种改变可引起免疫缺陷、过敏、炎症、肿瘤。
综上所述,BOS、PTLD 仍是儿童肺移植后严重危及生命的并发症,T 淋巴细胞亚群的变化是上述并发症的促进因素,而且这种现象在< 7 岁患儿中更明显。肺移植虽然是唯一挽救终末期肺病患儿生命的措施,但其只能延长患儿生命有限,更长期的生存及更高的生活质量才是医学研究的方向。低年龄儿童肺移植后生存期短,移植后肺部结构、免疫状况是无法避免的问题,也是延长生存期的突破点。随着肺移植儿童数量的增多,部分患儿移植后会在儿科病房甚至 PICU 进行治疗,本研究可以为肺移植后患儿的诊治提供参考。然而本研究是单中心数据分析,研究病例数量尚少,结论尚存在局限性,因此尚需增加病例数量及深化年龄分组,以得出更可靠的结论。此外,对 7 例存在肺移植患儿尚需针对气道、淋巴细胞亚群、并发症等监测指标进行长期随访。
好文章,需要你的鼓励
















