


Advanced Science | 王凯团队发现智能纳米药物通过葡萄糖饥饿和铜死亡协同增强肺癌𝛼PD-L1 疗法

2024 年 12 月 4 日,浙江大学医学院附属第四医院王凯教授团队在 Advanced Science 杂志在线发表题为「A Smart Nanomedicine Unleashes a Dual Assault of Glucose Starvation and Cuproptosis to Supercharge αPD-L1 Therapy」的研究论文。肺癌一直是全球范围内癌症相关死亡最多的肿瘤之一,近年来免疫疗法为肺癌患者提供了理想的治疗效果,然而仍有很大一部分患者不能从中获益。本研究首先在肺癌细胞中发现葡萄糖限制与胞内铜离子代谢平衡有密切的相关性,并且协同葡萄糖饥饿和铜代谢的改变可以调节肺癌细胞中的 PD-L1 表达。在此基础上,本研究进一步通过将肺癌细胞膜伪装到载有葡萄糖氧化酶的层状双氢氧化物纳米粒子(Cu-LDHs)上,合成了一种智能仿生纳米输送系统 CMGCL,用于癌症代谢靶向干扰,增敏肺癌αPD-L1 抗体治疗(图 1)。
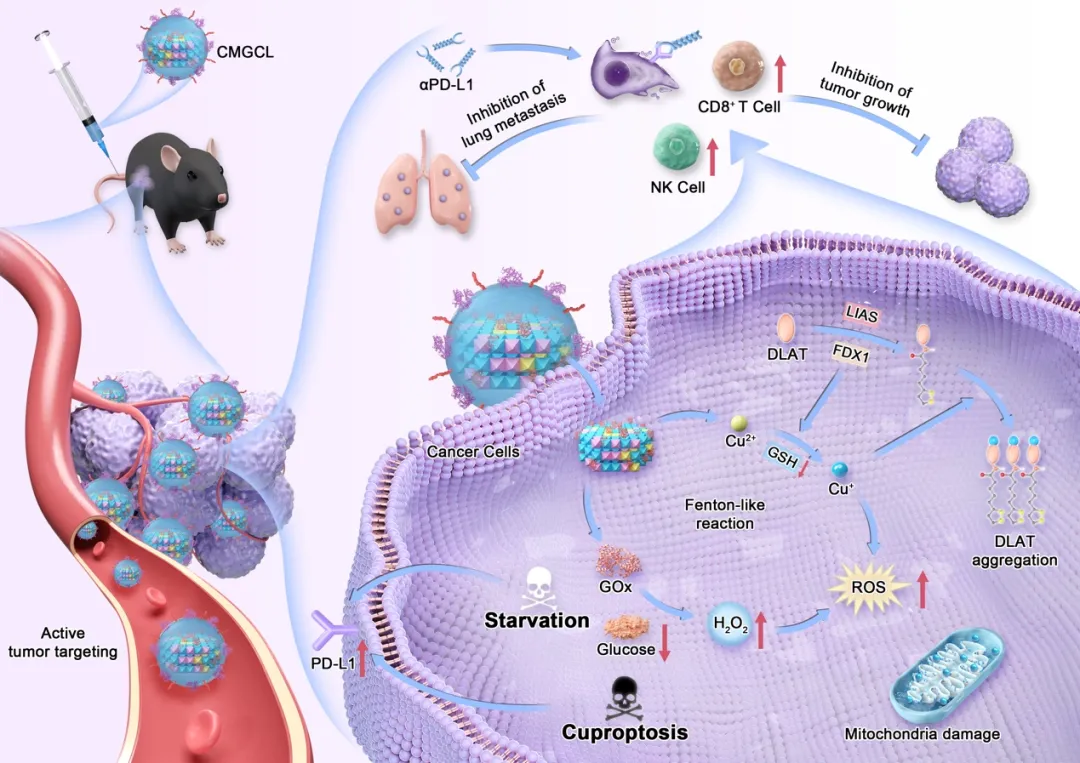
αPD-L1 抗体是肺癌免疫治疗中的有效治疗手段。然而,由于 PD-L1 表达不足和肿瘤微环境内的免疫反应功能失调,仍有很大一部分患者对治疗的反应不佳。此外,接受αPD-L1 单药治疗的患者通常会不同程度地产生耐药性或免疫相关不良反应,最终抑制治疗效果。目前,联合治疗是增强肺癌免疫治疗的有效手段,但传统治疗带来的副作用限制了更好的临床疗效。
本研究从肺癌代谢特征出发,寻求增敏αPD-L1 抗体治疗的新型高效、生物相容性的联合疗法。葡萄糖是肿瘤细胞生命活动的主要代谢营养物质,而金属离子是线粒体内许多酶复合物形成不可或缺的部分,对三羧酸循环至关重要。在本研究中,我们首次揭示了葡萄糖限制与细胞内铜离子代谢平衡具有内在相关性,并且与铜死亡相结合可以协同上调肺癌细胞中的 PD-L1 表达(图 2)。
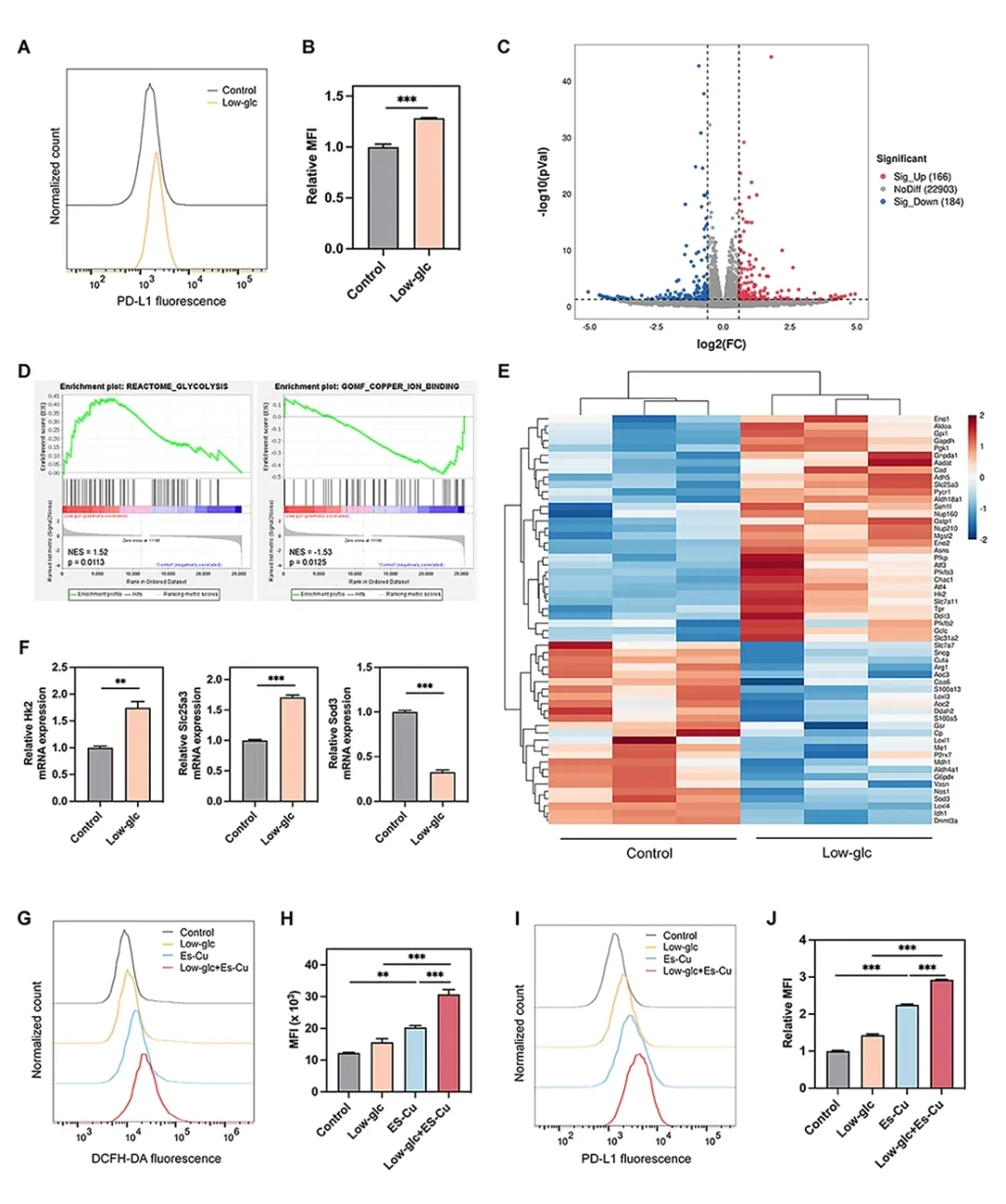
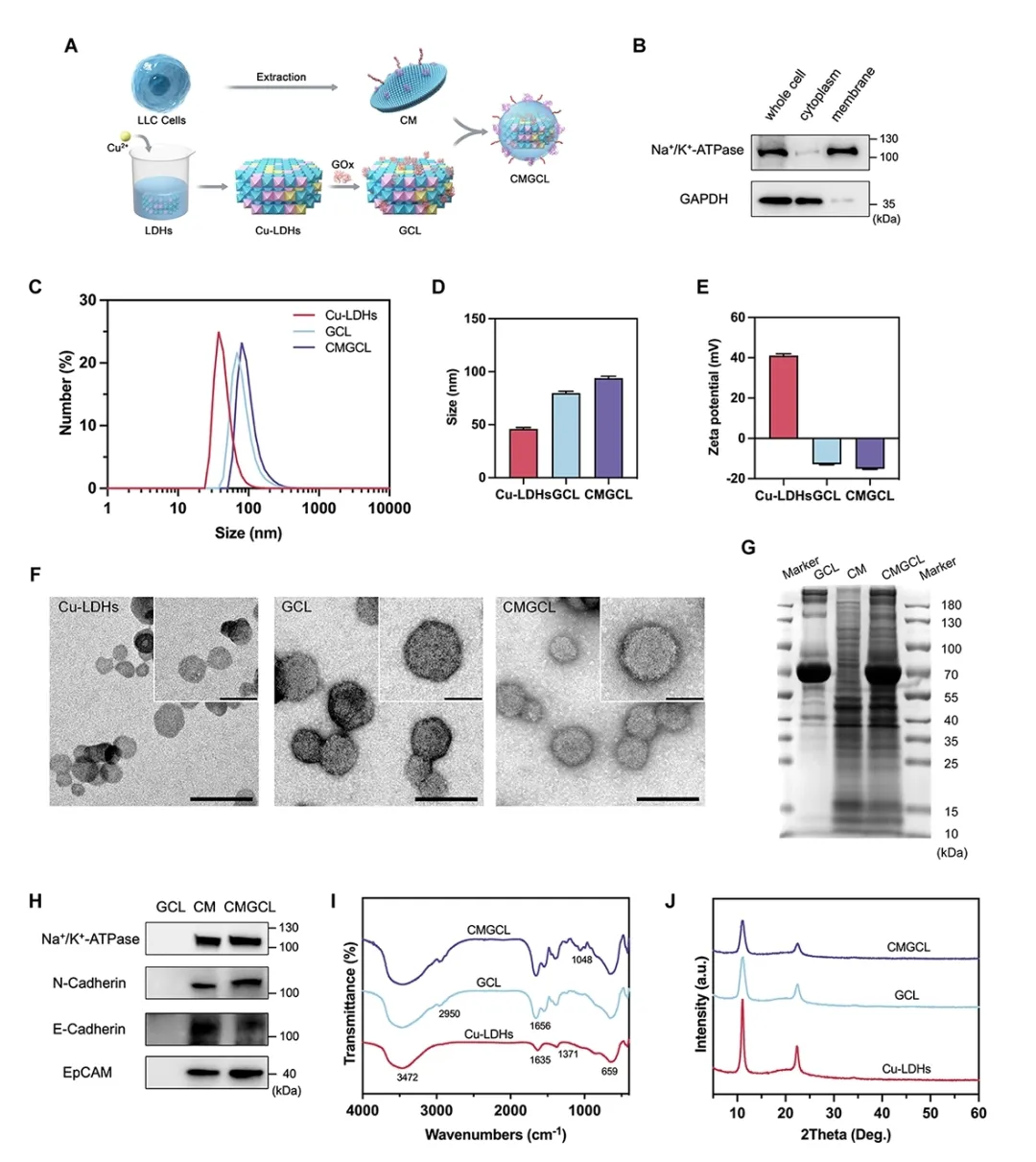
在此基础上,为了更好地达到联合治疗效果,我们设计并合成了一种靶向肺癌细胞的智能纳米药物 CMGCL,通过将肺癌细胞膜伪装到负载葡萄糖氧化酶(GOx)的铜掺杂的层状双氢氧化物纳米粒子(Cu-LDHs)上。通过 Western blot 及 SDS-PAGE 实验验证了细胞膜的成功提取及包覆,并采用 DLS, TEM, FT-IR, XRD 等实验验证了 CMGCL 的成功合成(图 3)。
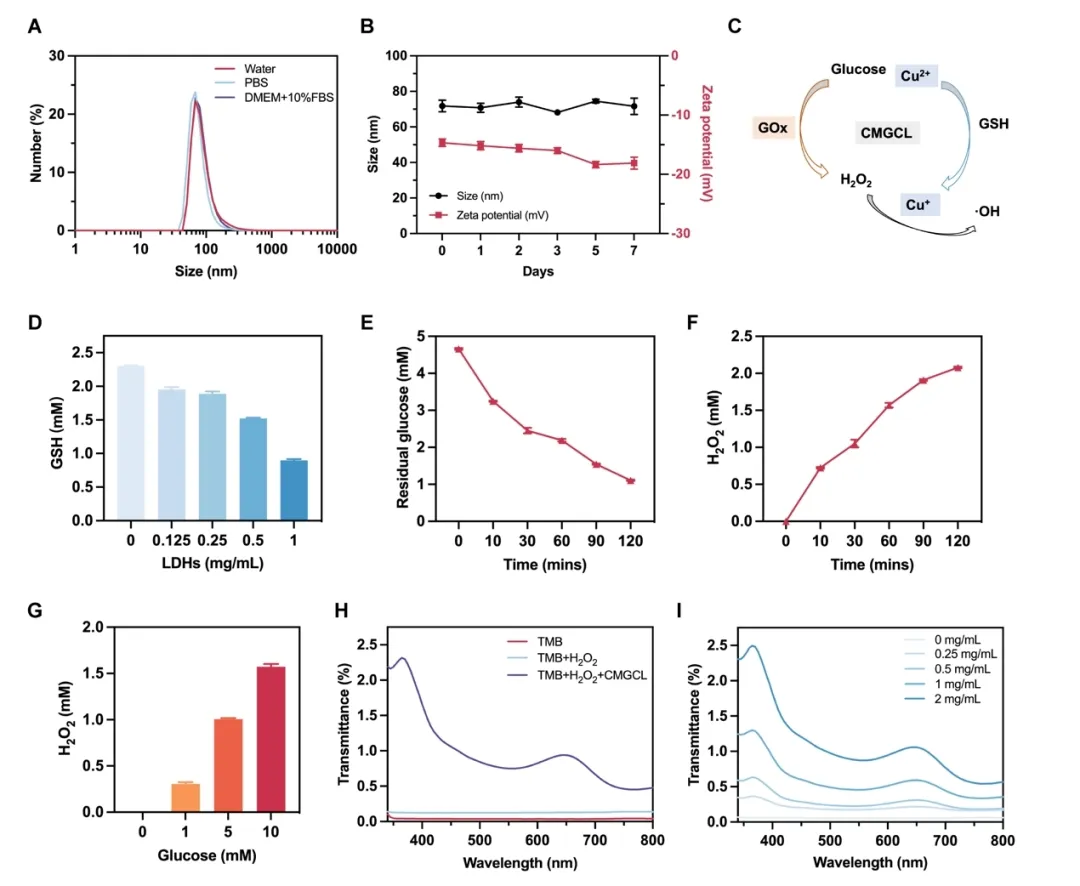
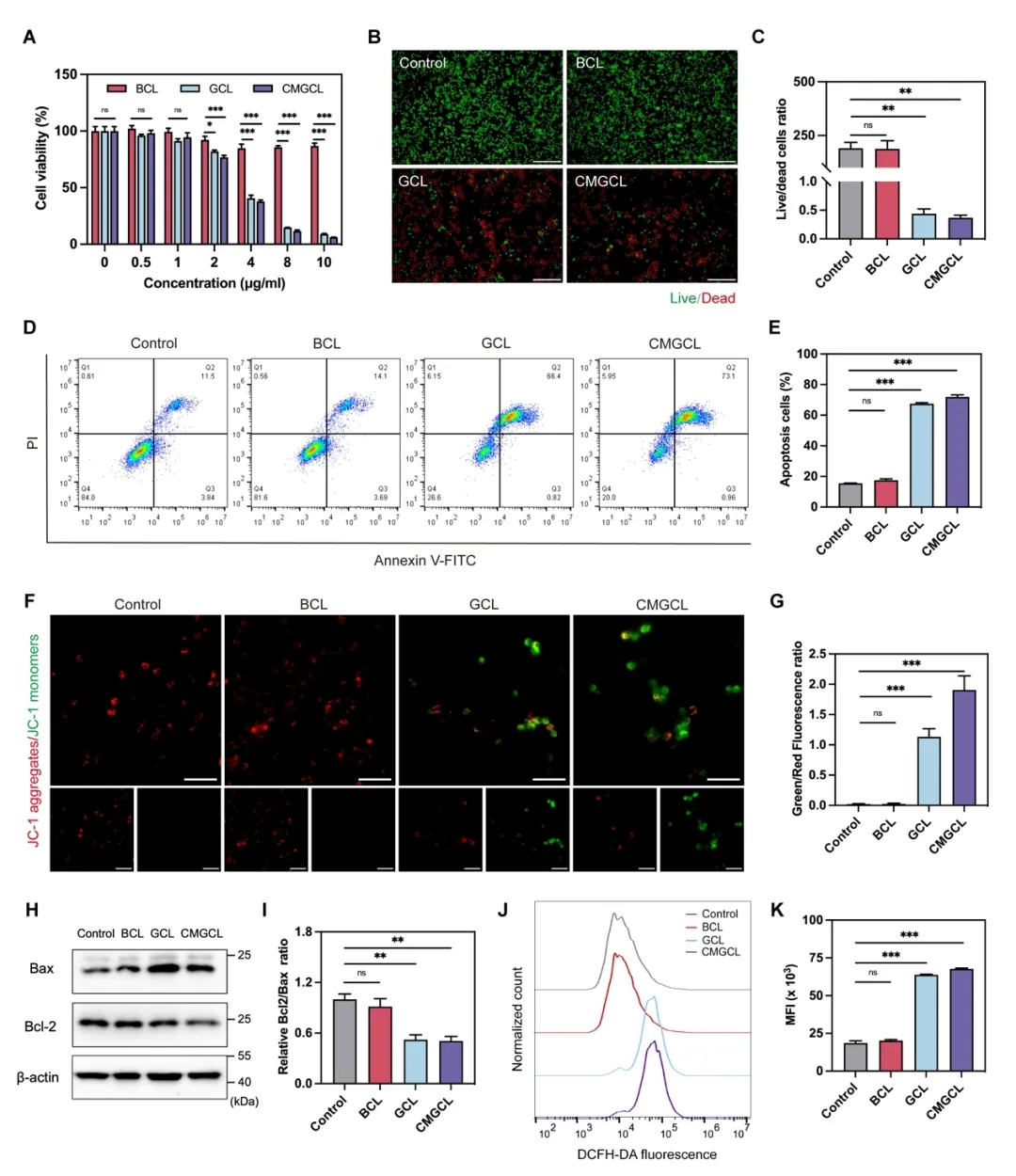
研究结果表明,CMGCL 具有良好的稳定性,且可以成功实现由铜离子的氧化还原引起的 GSH 消耗、由 GOx 催化的葡萄糖饥饿和 H2O2 生成,并进一步通过类 Fenton 反应将产生的 H2O2 转化为有毒的•OH(图 4)。
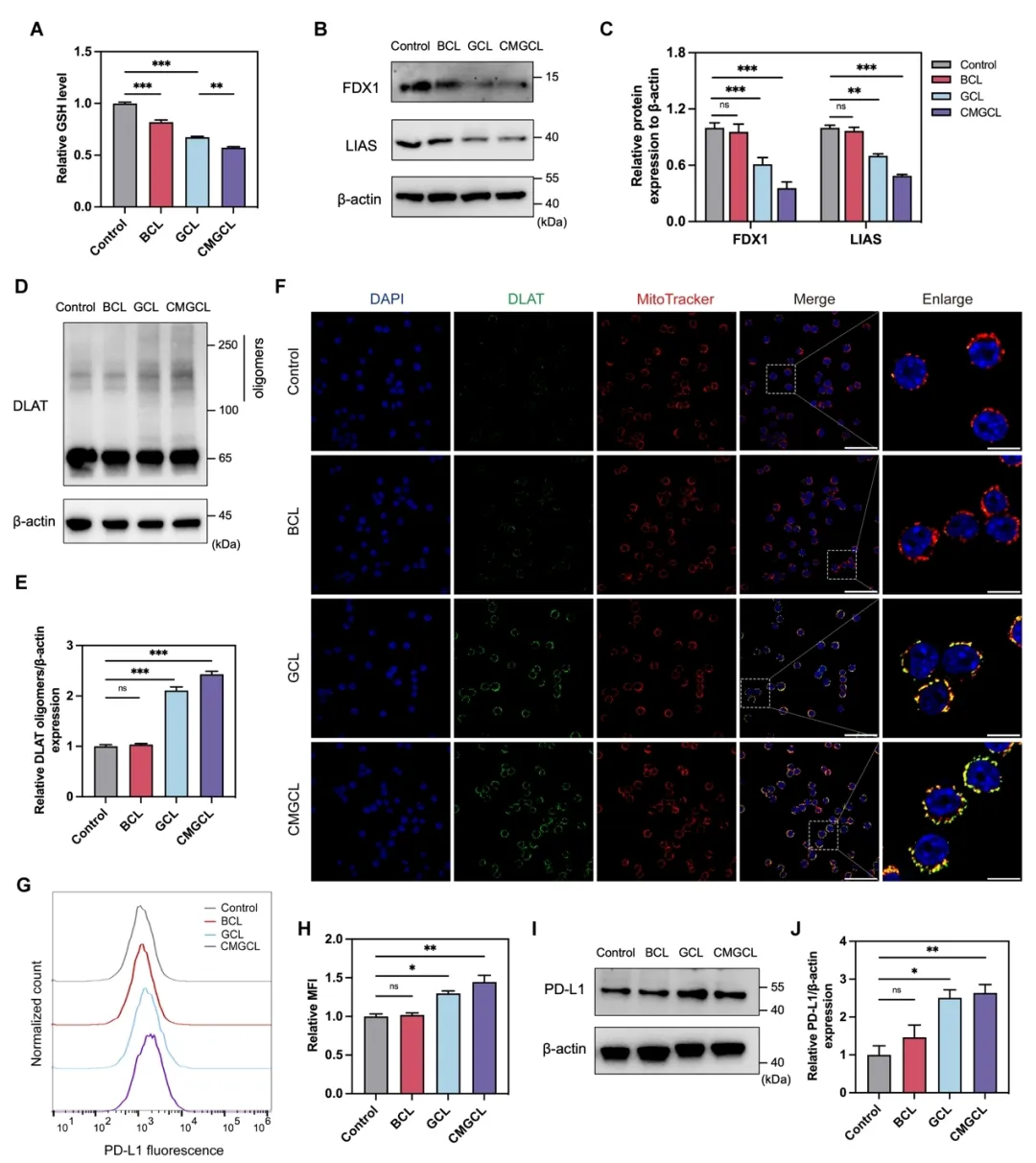
这一系列级联反应导致 CMGCL 在肺癌细胞 LLC 中表现出高细胞毒性,进一步研究显示,这种细胞毒性伴随着显著的线粒体功能受损,胞内 GSH 水平降低,氧化应激水平升高,以及最终细胞铜死亡的产生。同时,CMGCL 所带来的葡萄糖饥饿及铜死亡效应也明显上调了肺癌细胞的 PD-L1 表达(图 5,6)。
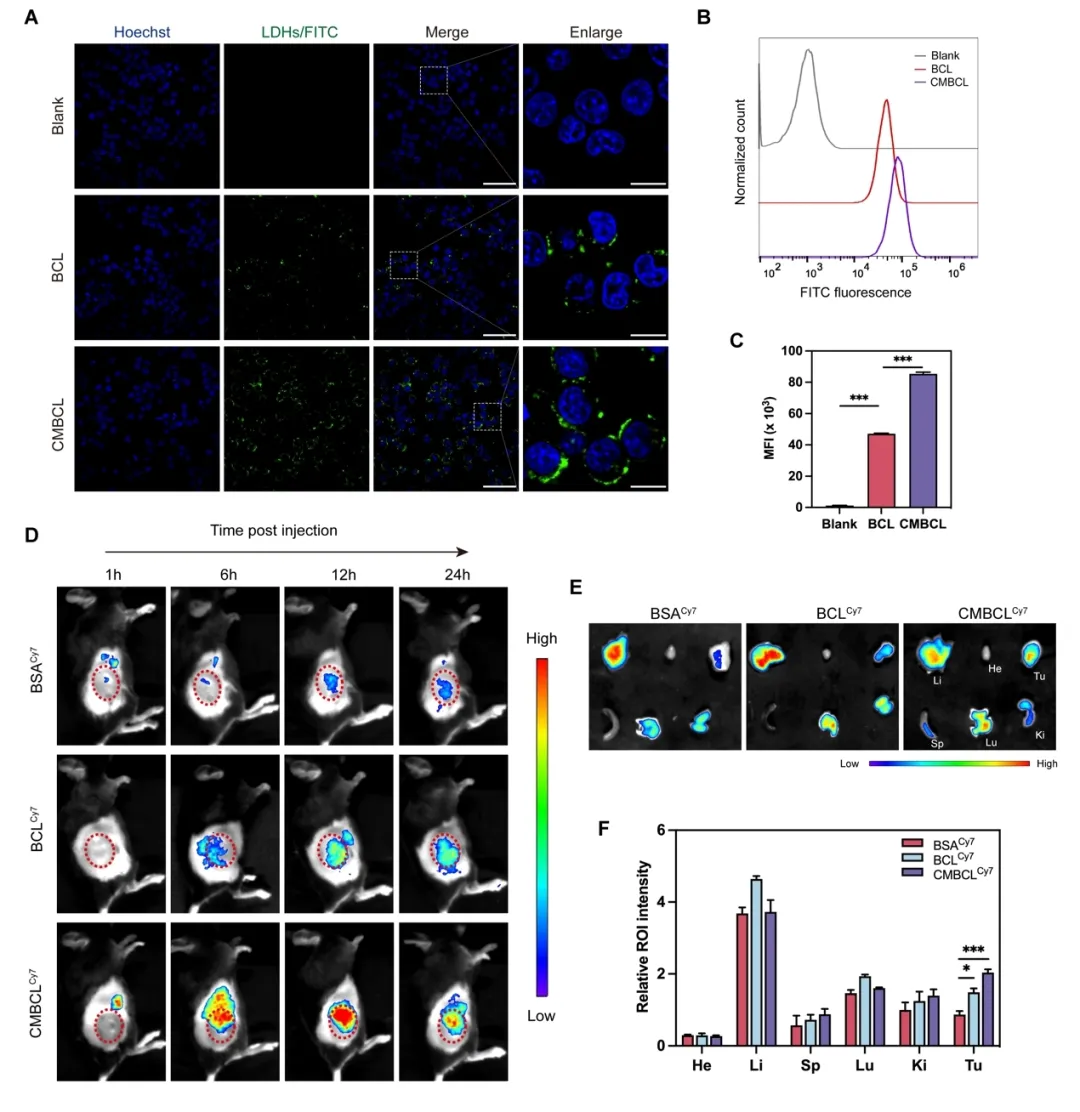
癌细胞膜伪装的仿生纳米材料具有通过对亲本细胞的膜特异性亲和力实现同型靶向的潜力,并具有优异的生物相容性。本研究中,肺癌细胞膜包被后的 LDHs 也表现出了理想的肺癌靶向效率。体外细胞摄取及体内成像实验证实,癌细胞膜包被在体外和体内均能很好地提高 Cu-LDHs 的肿瘤靶向效率(图 7)。
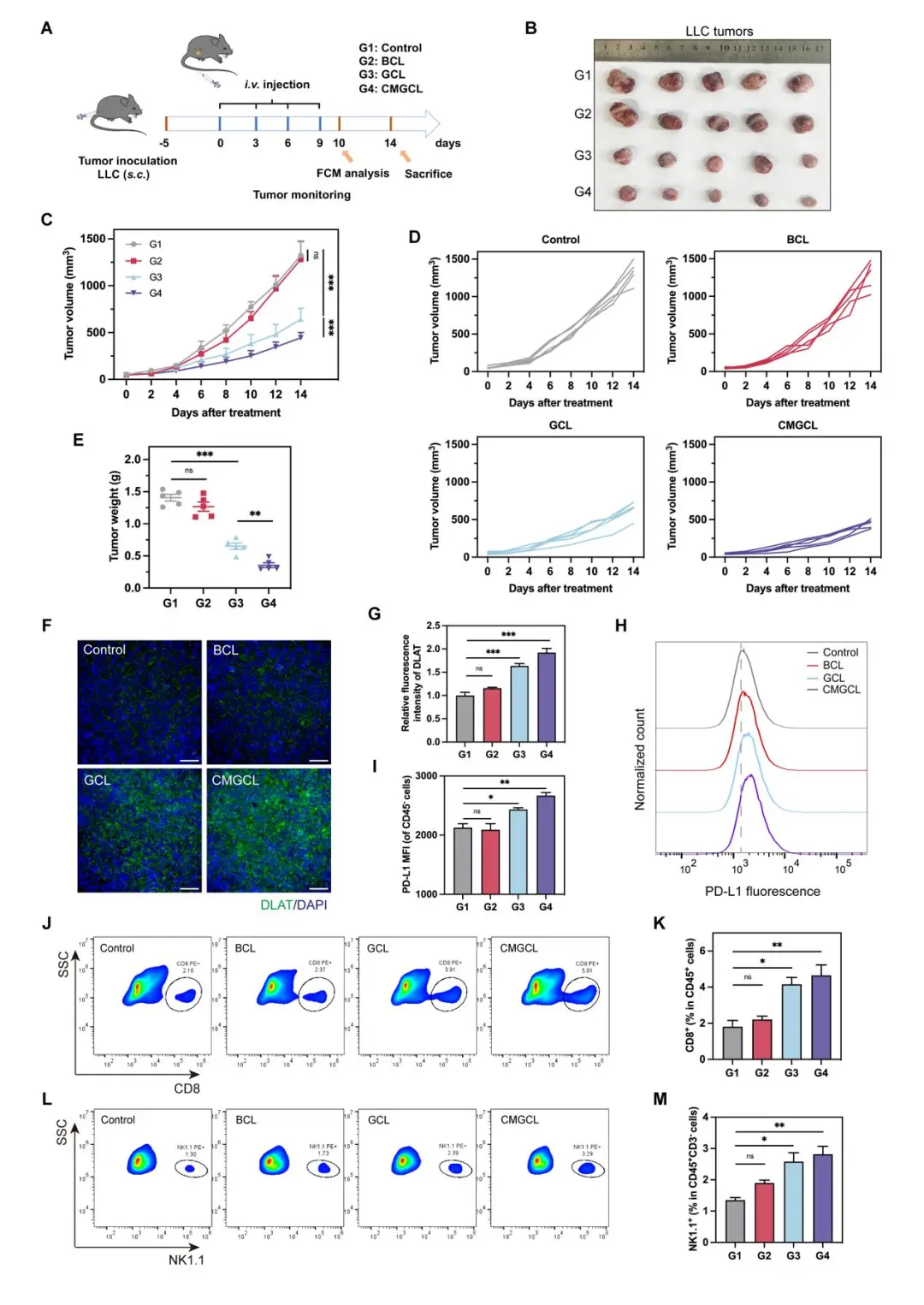
体内实验证实,CMGCL 在 LLC 荷瘤小鼠中表现出显著的抗肿瘤疗效,并且能够上调肿瘤微环境中 CD8+ T 细胞及 NK 细胞的比例,同时可以激活细胞铜死亡及 PD-L1 表达上调(图 8)。进一步联合αPD-L1 抗体治疗,在原发及肺转移性 LLC 小鼠肿瘤中均表现出显著优于单药治疗的增强效应(图 9)。
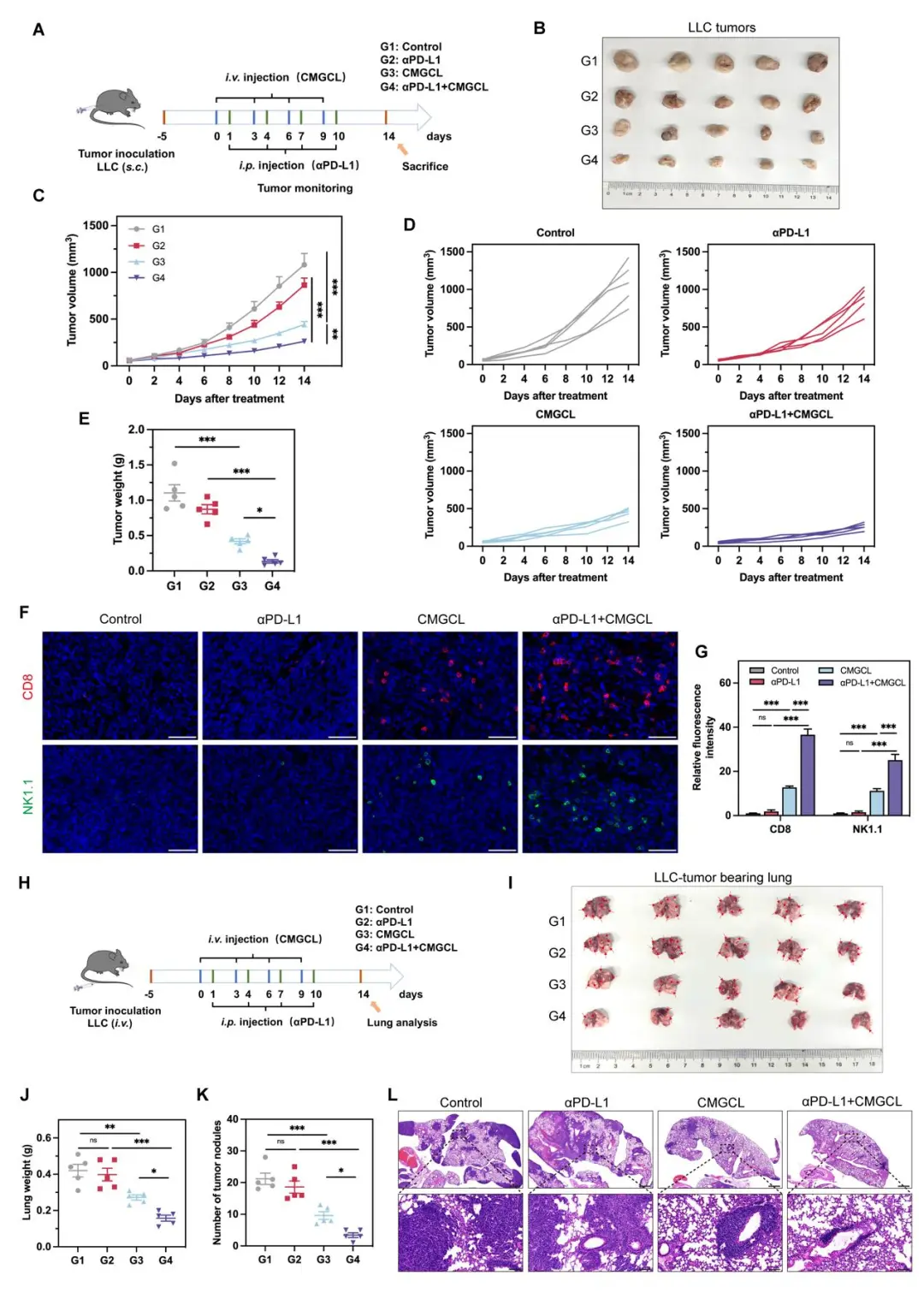
总体而言,本研究中提出的组合策略证明了葡萄糖饥饿和铜死亡对增强肺癌αPD-L1 治疗的协同作用,并显示了 CMGCL 这一新型仿生纳米药物作为αPD-L1 联合治疗的潜力。
好文章,需要你的鼓励













