ASH 2023 丨刘红星团队领导多中心研究,揭示 RARG 融合基因阳性不典型 APL 的关键发病和 ATRA 耐药机制
文章来源:肿瘤瞭望
编者按:2023 年第 65 届美国血液学会(ASH)年会已圆满闭幕。作为全球血液病领域的权威学术盛会,ASH 年会上呈现的学术报告代表了血液病领域的最重要及前沿的研究成果。在本次大会上,陆道培医院刘红星教授团队 汇报的一项多中心研究,揭示了 RARG 融合基因阳性不典型急性早幼粒细胞白血病(APL)的关键发病和全反式维甲酸(ATRA)耐药机制,本期特别将该研究内容整理如下,并邀请到刘红星教授进行精彩点评。

研究背景
全反式维甲酸(ATRA)的应用已在伴 PML::RARA 融合基因的急性早幼粒细胞白血病(APL)的治疗中取得了巨大成功。但有少部分患者实验室检查和临床表现为 APL 的特征,但 PML::RARA 阴性,也被称为变异型 APL。这部分患者常携带其他的 RARA、RARG 或 RARB 相关的融合基因。近年来,RARG 融合基因阳性 APL(RARG-APL)病例的报道越来越多。由于 ATRA 在治疗经典型 APL 方面的巨大成功,因此几乎所有已报道的 RARG-APL 病例都经验性尝试使用 ATRA 治疗,但几乎所有可评估的病例均表现为对 ATRA 治疗耐药。但另一方面,多项体外实验均报道转染 X::RARG(X 代指融合伙伴基因)融合基因的细胞株对 ATRA 表现出极好的响应性,与患者的临床耐药形成鲜明的对比。
方法
本研究共纳入了来自 11 个中心的 22 例 RARG-APL 病例,包括一部分之前已发表的病例。对这些病例的 RARG 融合基因的结构特征进行深入分析,对新发现的 RARG 3' 端融合和配体结合结构域(LBD)的螺旋结构 H11_12 截短进行蛋白结构模拟分析。采用优化的 UAS/GAL4 报告系统,在体外细胞实验中评估含与不含 RARG 3' 端融合和 LBD-H11_12 截短的融合蛋白对 ATRA 的反应性。
结果
入组病例中,男性 15 例,女性 7 例,年龄 0.9~69 岁(中位 38 岁)。形态学和免疫表型分析均显示有 APL 的特征表型。用转录组测序和常规生物信息流程分析融合基因时均报告了 RARG 基因 5' 端的断裂和融合事件,但断裂位点具有变异性。本研究的病例中共鉴定了 7 种 RARG 5'端的融合伙伴基因,其中 CPSF6、HNRNPC 和 NUP98 见于 2 个及以上病例。
本研究首先在陆道培医院的 3 个先证病例中发现 RARG 基因除了 5' 融合外,3' 端也发生了断裂和融合事件,并且 RARG 3' 端的断点一致性地位于其第 9 号外显子末端,导致第 10 号外显子缺失。经 RT-PCR 证实这三个病例中 RARG 5' 和 3' 端的融合事件均位于同一顺反子中。例如,在第一个先证病例中,融合转录本是三段式的 NPM1::RARG::NPM1 串联拼接,而非分别发生了 NPM1::RARG 和 RARG::NPM1 两个相互独立的转录本。这是一种新的之前未报道过的融合基因形式,本研究中将其命名为三段式融合。
在 3 例先证病例中均发生了 RARG 的三段式融合,蛋白结构分析显示 3' 端的融合事件导致了 RARG-LBD-H11_12 截短。LBD-H11_12 在 RARG 响应 ATRA 作用后与共抑制因子(CoR)解离,转而与共活化因子(CoA)结合的构象变化中发挥着关键作用。因此我们推测 RARG 融合蛋白的 3' 端融合导致的 LBD-H11_12 截短在是这些患者对 ATRA 治疗无反应的关键机制。为了确认这种新形式的三段式融合现象,以及 RARG 的 3' 端融合是否在 RARG-APL 中具有重现性,我们进一步分析了来自多中心的 19 例 RARG-APL 验证病例。
对验证病例的分析进一步证实所有 RARG-APL 病例均存在 RARG 3' 端融合事件。在可获得 cDNA 样本的 3 个验证病例中,用 RT-PCR 验证了 RARG 的 5' 和 3' 端融合事件也均位于同一顺反子中。所有病例的 RARG 基因的 3' 断裂位点高度一致性地位于 RARG 第 9 号外显子末端,导致 RARG 第 10 号外显子截短和 LBD-H11_12 编码区缺失。
在 11 例病例中,RARG 3' 端的融合伙伴基因与 5' 的相同,即为 X::RARG::X 型融合;而在另 11 例病例中,RARG 3' 端拼接的是转座元件序列,即为 X::RARG::Y 型融合。RARG 3' 端融合伙伴以 LINE-L2a 最多见(8 例患者),所累及的 LINE-L2a 的基因组座位位于 RARG 基因上游 4.2 Kbp 处。基因表达分析显示相关转座元件座位发生了异常活化表达。与 RARG 3' 端融合的转座元件序列都携带了 mRNA 必需的 polyA 信号序列。分析显示这些转座元件序列是通过转座机制而非染色体易位机制参与了 RARG 融合基因的形成。
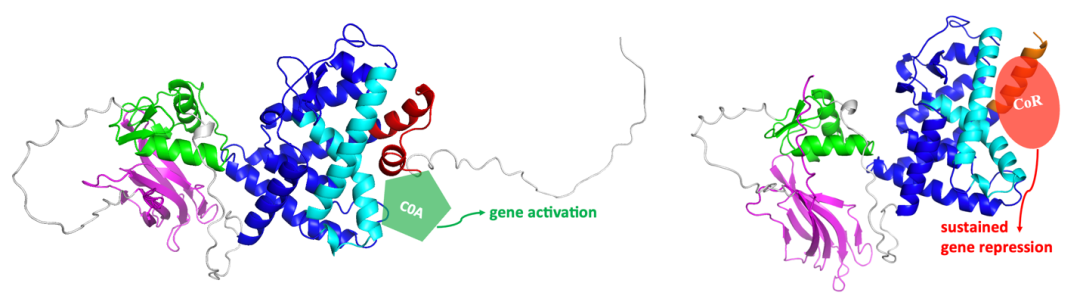
RARG 外显子 10 编码其 LBD-H11_12。LBD-H11_12 在 RARG 响应 ATRA 作用时的变构反应中发挥关键作用,导致 LBD 与共抑制因子(CoR)解离并转而与共活化因子(CoA)结合,从而在 ATRA 作用下由抑制基因转录转换为活化基因转录。蛋白构象分析显示这种新形式的 RARG 三段式融合 RARG-LBD-H11_12 截短,因此丧失对生理和药理浓度 ATRA 反应的变构能力(图),成为导致 APL 发病和对 ATRA 治疗无反应的关键分子机制。体外细胞实验中也进一步验证了有完整 RARG-LBD 的融合蛋白对 ATRA 反应良好,而发生了 LBD-H11_12 截短的融合蛋白完全丧失了对生理和药理浓度 ATRA 的反应性。
结论
本研究清晰地揭示了这种新发现的三段式融合基因是 RARG-APL 的重要分子病因,并且是这组疾病中严格重现的分子异常形式。这种特殊形式的三段式融合中,RARG 5' 端融合介导了融合蛋白的异常表达,3' 端融合导致 LBD-H11_12 截短和丧失响应 ATRA 作用时的变构能力。
本研究的发现既解释了 RARG-APL 的关键发病机制,又阐明了对 ATRA 治疗无反应的分子机制。从发病机制上明确了对 RARG-APL 患者不应再尝试无效的 ATRA 治疗,为进一步研究有效的治疗方案提供了新的正确的研究方向。三段式融合的形成需要两次基因组剪接或转座事件,这也解释了这部分 RARG-APL 发病率低的主要原因。由于 RARG-APL 与 PML::RARA-APL 在分子机制和临床治疗方面均有显著差异,因此我们建议将 RARG-APL 列为与 PML::RARA-APL 相独立的 AML 分子分型。
专家点评:
由于中国专家们的卓越贡献,发现 ATRA 和砷剂治疗 APL 有特效。目前通过联合应用 ATRA 和砷剂治疗已使经典型的 PML::RARA-APL 由临床病情最凶险的白血病成为治愈率最高的白血病,也成为白血病和各种肿瘤精准诊疗的典范。但 PML::RARA 阴性的不典型 APL 患者的治疗仍存在很大挑战,患者的治疗结局仍很不理想。近年来 RARG 融合基因阳性的 APL 的报道逐年增多。既往报道的 RARG-APL 患者临床治疗时均表现为对 ATRA 耐药,但实验室模拟的 X::RARG 融合蛋白均对 ATRA 反应敏感。这两种现象的鲜明对比一直缺乏合理的解释。
由于之前熟知的 PML::RARA 的融合事件发生于 RARA 的 5' 端,并且所有既往报道的融合基因都是 X::Y 型的两段式融合方式。因此在既往关于 RARG-APL 的报道中,对于 RARG 融合基因的研究也主要关注和报道了 RARG 5' 端的融合。另一方面,由于 RARG 3' 端的融合伙伴主要为对分析更具有挑战性的转座元件序列等原因,因此 RARG 3' 端的融合事件一直被忽略。所以既往的体外实验中,也都是模拟的发生了 X::RARG 型的不含 3' 端融合的融合蛋白。
本研究原创性地揭示了在所有 RARG-APL 患者中,RARG 融合基因均发生了一种新形式的三段式融合,即 X::RARG::Y 或 X::RARG::X 形式的融合。在三段式 RARG 融合中,5' 端融合事件介导了融合蛋白的异常表达,3' 端融合事件导致了关键的 LBD-H11_12 的截短。该发现同时阐明了 RARG 融合导致 APL 发生和对 ATRA 治疗无反应的关键分子机制,是 RARG-APL 发病机制研究的具有重要意义的事件。本研究还是第一次系统地报道具有病理意义的三段式融合基因的现象,第一次报道转座元件介导病理性融合基因的发生,对于这两方面的进一步研究也具有重要的启示意义。
本研究是一项多中心协作研究,先证病例和验证病例由来自陆道培医院、苏州大学一附院、北大人民医院、南昌大学一附院、中国医学科学院血液病医院、哈医大二院、山东省立医院、中南大学湘雅二院、青岛大学附属医院、中国医科大学一附院、北京朝阳医院等多中心提供,一起验证了这项在 APL 的分子机制方面又一项中国专家们原创性的重要发现。该研究也充分体现了中国学者们的协作精神!
好文章,需要你的鼓励