Front Med | 蒋瑛医生:GM-CSF 或可促进 CAR-T 再激活和细胞免疫恢复,且不诱发 CRS
随着嵌合抗原受体 T 细胞(CAR-T)治疗应用的逐渐广泛,临床医生需要面对和解决的新问题也越来越多,源于临床、付诸研究、产生循证是回答这些问题的科学方法。
近期,高博医学(血液病)上海研究中心上海闸新医院/上海力泉医院王椿教授团队在《医学前沿》(Frontiers in Medicine)杂志发表了一项关于 CAR-T 治疗后粒细胞-巨噬细胞集落刺激因子(GM-CSF)应用的临床研究报告,该研究由高博医学(血液病)上海研究中心上海闸新医院/上海力泉医院医疗总监朱骏主任和上海雅科生物科技张鸿声教授共同担任通讯作者。
研究提示 GM-CSF 可促进 CAR-T 再激活和细胞免疫恢复,不诱发细胞因子释放综合征(CRS),初步证实了在 CAR-T 治疗后患者中 GM-CSF 应用的可行性,为临床带来了有益的参考。为此,我们特邀该研究的第一作者蒋瑛医生接受专访,解读研究数据,分享研究体会,展望未来方向。
研究者说
大胆假设,小心求证:选择合适人群,为 GM-CSF「正名」
Q1:团队开展此项研究的背景和初衷是什么?
蒋瑛医生:关于 CAR-T 治疗后中性粒细胞减少的处理,NCCN 指南建议经验性应用广谱抗生素,并考虑使用粒细胞集落刺激因子(G-CSF),但不推荐使用 GM-CSF。因为 GM-CSF 与 G-CSF 不同的之处在于:GM-CSF 在升白的同时也会刺激巨噬细胞,而动物模型中显示巨噬细胞产生的 IL-6、IL-1 和一氧化氮会诱发或加剧 CRS。
但事实上 G-CSF 也并非足够安全。既往纪念斯隆-凯特琳癌症中心的研究者发表过相关的报道(Sauter CS, et al. Blood,2019,134(7):626-635.),对低危的复发/难治性 B 细胞非霍奇金淋巴瘤患者行造血干细胞移植(ASCT)后+2 和+3 天序贯 19-28z CAR-T 治疗,在 ASCT 之后+1 天予了长效 G-CSF。然而,该研究中观察到较高的神经毒性发生率,作者分析可能与长效 G-CSF 有一定关系。
此外,关于 GM-CSF 与 G-CSF 的疗效,本中心王椿教授团队曾经发表在《临床肿瘤学杂志》(Journal of Clinical Oncology,JCO)上的一项研究(Wan L, er al. J Clin Oncol,2015,33(34):3999-4006.)显示,在异基因造血干细胞移植(allo-HSCT)后使用 GM-CSF 预防侵袭性真菌感染的效果显著优于 G-CSF,这也得益于 GM-CSF 不仅能够促进粒细胞恢复,还可促进巨噬细胞和单核细胞的恢复,预防感染的效能更强。
溯源 CAR-T 治疗后 CRS 的发生机制,是由一系列细胞因子综合作用的结果,除 GM-CSF 参与之外,还需要 IL-2、IL-6、IL-8、干扰素-γ、穿孔素、颗粒酶 B 等众多因素共同参与。由此我们假设,当中性粒细胞减少且 CAR-T 细胞拷贝数下降时,细胞因子总体水平也会减低,此时给予 GM-CSF 治疗,这一单一因素所带来的影响或许并不足以诱发 CRS。因此,GM-CSF 或许对这部分 CAR-T 治疗患者而言是安全的。
由此,源于机制的假设以及 GM-CSF 较 G-CSF 更强效的作用,促使我们希望通过对应用人群和时机的选择,初探 GM-CSF 在 CAR-T 治疗后中性粒细胞减少同时伴有 CAR-T 细胞扩增下降的患者中运用的安全性和有效性,因此开展了这一小样本研究。
预期之中,意料之外:安全有效「升白」,观察到 CAR-T 细胞显著扩增
Q2:请您为我们简要介绍和解读本研究结果。
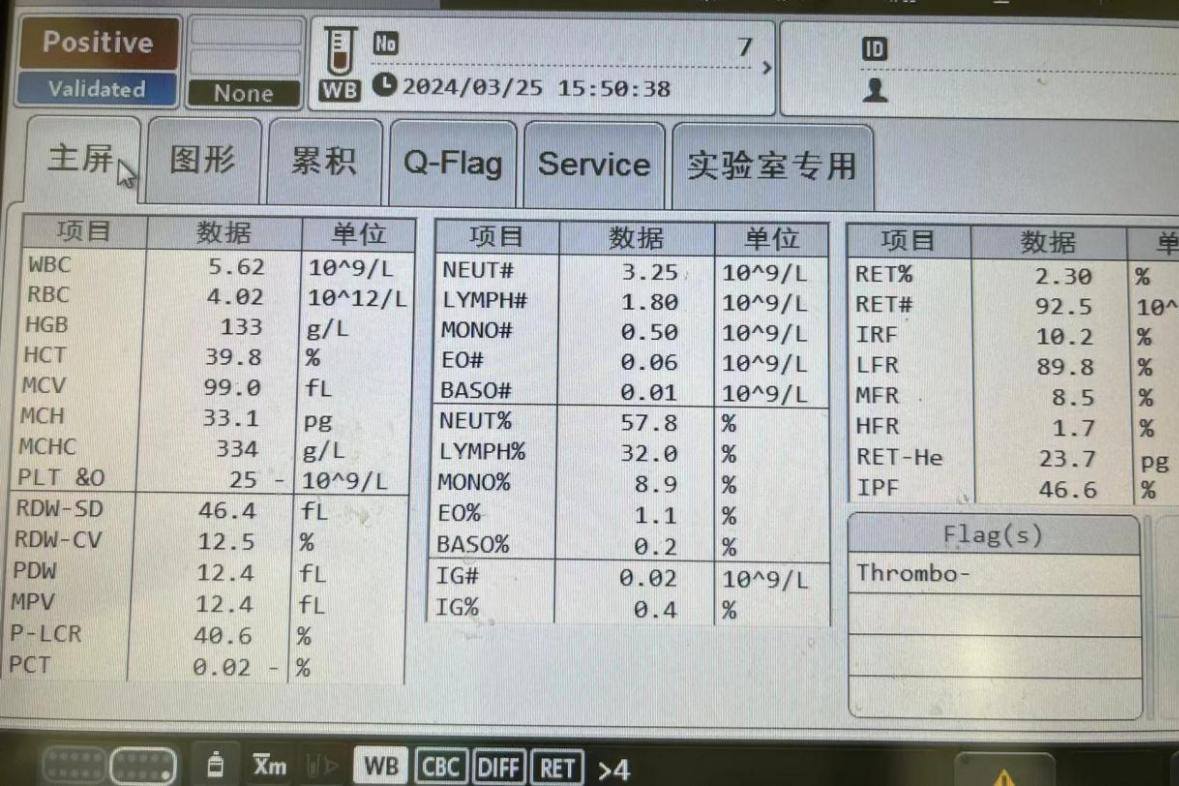
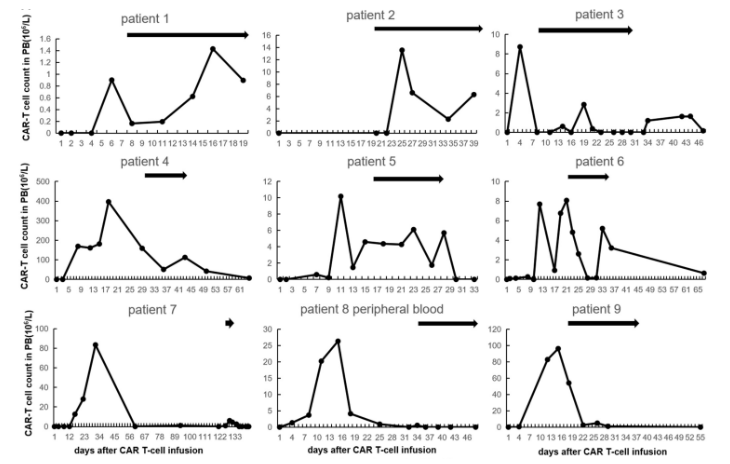
蒋瑛医生:本组 9 例患者均为 CAR-T 治疗(无论靶点类型)后 ANC<1500/mm3、感染风险较高;病例 2 回输 CAR-T 后一直无扩增(图 1),其余患者为 CAR-T 扩增一段时间后下降。
从研究结果可以看到,在 GM-CSF 治疗期间,无一例患者发生 CRS 和致死性感染,安全性良好;且 9 例患者外周血白细胞均增加,同时观察到中性粒细胞、淋巴细胞和 CD3-CD16+CD56+自然杀伤细胞增加,升白效果确切。
令我们意外和惊喜的是,本研究还观察到绝大多数(7 例)患者在 GM-CSF 治疗后 CAR-T 细胞明显扩增(图 1),可能得益于 GM-CSF 刺激所带来的多系细胞的整体上升,包括粒细胞、淋巴细胞、巨噬细胞等,细胞因子相互作用,刺激了 CAR-T 细胞的扩增。
如果 GM-CSF 这一作用后续被进一步证实,将很大程度上解决当前临床中的一个常见难题,即常规用于促进 CAR-T 细胞扩增的药物(如地西他滨、来那度胺、BTK 抑制剂等)或放疗通常都会导致白细胞、中性粒细胞等降低,这对于本身合并有中性粒细胞减少的患者而言是「雪上加霜」。
此外,刺激 CAR-T 扩增的 PD-1 单抗存在引起免疫激活反应,尤其是 CAR-T 后计划续接移植的患者,如果移植前用过 PD-1 单抗,则移植后发生移植物抗宿主病(GVHD)、免疫反应、植入综合征等的风险明显增加,因此 PD-1 单抗应用同样受限。由此,GM-CSF 有望「一箭双雕」地解决这一问题,既能辅助 CAR-T 扩增,也能促进血细胞恢复,必要时可以与其他促 CAR-T 扩增药物联用。
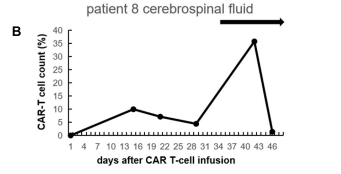
另一个有趣的现象是,尽管病例 8 接受 GM-CSF 治疗后外周血中 CAR-T 细胞一直未见扩增,但脑脊液中 CAR-T 细胞有一过性扩增(图 2)。病例 8 是一例原发于中枢神经系统的淋巴瘤患者,在定期脑脊液监测中意外地观察到这一现象。提示 GM-CSF 的聚集浓度和作用强度可能存在组织异质性,值得进一步探究。
溯源机制,印证假设:GM-CSF 单一因素不易诱发 CRS
Q3:如何解释本研究观察到的炎症标志物水平变化与临床结果的内在关系?
蒋瑛医生:为了观察 GM-CSF 干预如何影响其他炎症因子分泌水平,本研究还分析了多种炎症标志物的变化,结果显示,细胞因子、CRP 和铁蛋白不仅没有显著升高,相反,部分细胞因子和 CRP 还出现了具有统计学差异的显著下降(配对 T 检验)。这与未出现 CRS 和免疫效应细胞相关神经毒性综合征(ICANS)的临床安全性结果也是相符合的,值得进一步验证。
关于具体机制,我们在论文的讨论部分做了简要分析,原文分享如下:肿瘤浸润后,CAR-T 细胞分泌促炎细胞因子如 GM-CSF 和 IL-8,促进 CRS 主要生物标志物 IL-6 和 IL-8 的释放,这些细胞因子既往被证明是单核细胞依赖性的。
CRS 生物标志物的释放不依赖于 CAR -T 细胞与单核细胞之间的物理接触,表明当缺乏参与巨噬细胞活化的可溶性因子时可能避免 CRS。本研究中,GM-CSF 给药期间未观察到炎症标志物的显著升高;反而细胞因子(IL-17F、IL-1β、IL-4、TNF-α和 TNF-β)和 CRP 有显著降低,且 GM-CSF 在正常范围。因此,缺乏足够的可溶性因子是本研究没有观察到 CRS 和 ICANS 的可能原因。
深度验证,细化时机;联合探索,助益扩增
Q4:基于本研究结果,您认为未来还有哪些值得深入探索的方向?
蒋瑛医生:比较巧合的是,几乎与我们同期发表的一项来自美国麻省总医院的回顾性研究也探讨了 CAR-T 治疗中升白药物应用的时机问题(Miller KC, et al. Blood Cancer J,2022,12(10):146.)。
结果显示,对于淋巴瘤患者(接受 CD19 CAR-T 治疗),CAR-T 回输前预防性使用 G-CSF 较回输后使用显著增加了 ≥ 2 级 CRS 发生率,回输后应用的安全性可控可接受;多发性骨髓瘤(接受 BCMA CAR-T 治疗)中,CAR-T 回输后 2 天内与 3 天后应用 G-CSF 的安全性无显著差异。
虽然该研究针对的是 G-CSF 的应用,但同样提示应用时机对其安全性有重要影响。因此,基于我们这项研究的积极初步结果,未来可以进一步开展更大样本量的前瞻性研究,细化分析 CAR-T 治疗后 GM-CSF 的最佳应用时机(例如 CAR-T 细胞降至何种程度时),取得安全性、升白效果、CAR-T 扩增效果的最佳平衡。
此外,对于 CAR-T 扩增效果不理想的患者,是否可以将 GM-CSF 与其他促扩增药物联合应用,也非常值得探索,如果可行,则既平衡了其他药物的血液毒性,也可协同增强扩增 CAR-T 作用,使患者更大受益。
研究简介
研究背景
中性粒细胞减少和 CRS 是 CAR-T 治疗中两种主要的毒副反应。GM-CSF 是治疗中性粒细胞减少的一种理想药物,但对于接受 CAR-T 治疗的患者,GM-CSF 有加剧 CRS 的潜在风险。基于这种风险的发生机制,可以假设当宿主免疫功能和 CAR-T 细胞数量低下时,选择一个补充 GM-CSF 的最佳时机,或可避免诱发 CRS,在安全的前提下有效地治疗中性粒细胞减少。本研究及时评估了 CAR-T 治疗后当循环 CAR-T 细胞下降时给予 GM-CSF 干预的安全性和有效性。
研究方法
9 例患者在 CAR-T 治疗后出现中度中性粒细胞减少,中性粒细胞绝对计数 (ANC) <1500/mm3,同时伴有循环 CAR-T 细胞下降(其中病例 2 回输 CAR-T 后一直无扩增,图 1),给予 GM-CSF 治疗。
研究结果
GM-CSF 干预的中位持续时间为 15 天(4~30 天)。
CAR-T 扩增情况(图 1):9 例患者中有 7 例观察到外周血中 CAR-T 细胞扩增,中位基线和峰值分别为 0.85×106/L(0~50.9×106/L) 和 6.06×106/L(1.43×106/L~112.55×106/L)。峰值出现的中位时间在启动 GM-CSF 治疗后第 7 天(2~11 天),外周血 CAR-T 计数中位增幅为 2.84×106/L(0.38×106/L~61.65×106/L)。
此外,尽管病例 8 和病例 9 外周血中 CAR-T 细胞计数未见增加,但病例 8 脑脊液中 CAR-T 细胞百分比在第 6 天由 4.43% 增加到 35.78%,第 10 天下降到 1.38%(图 2)。
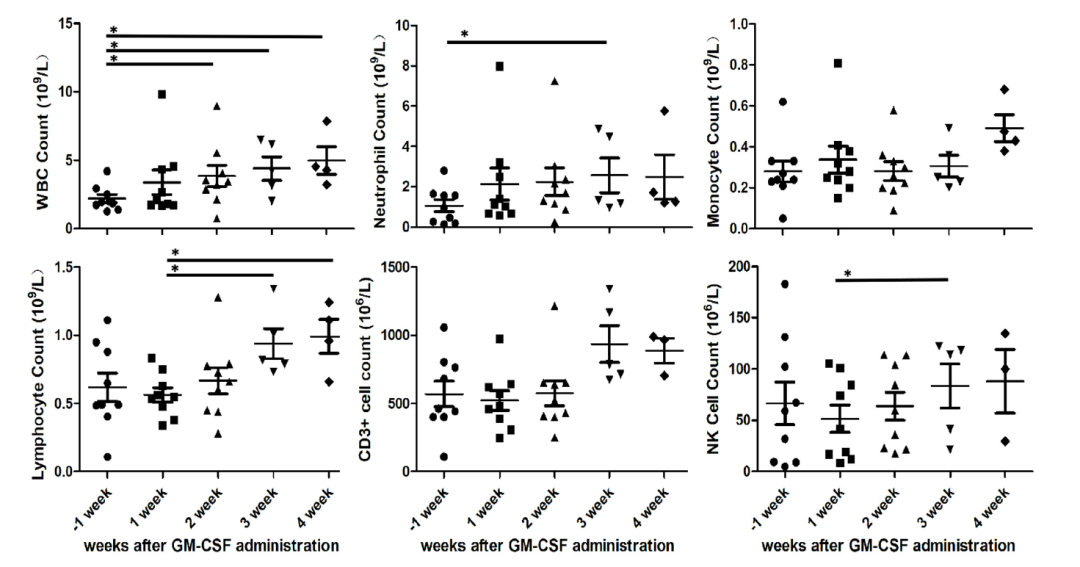
血细胞恢复情况:9 例患者均观察到外周血白细胞增加,恢复的中位起始时间为 9 天(1~14 天),持续时间为 17 天(3~53 天)。同时观察到外周血中性粒细胞、淋巴细胞和 CD3-CD16+CD56+自然杀伤细胞增加。
安全性:在 GM-CSF 治疗期间未发生 CRS 和致死性感染。
部分炎症反应减少:本研究监测了炎症标志物水平变化,如细胞因子、C 反应蛋白(CRP)和铁蛋白,均未观察到显著升高。相反,在随访 4 周时,细胞因子(IL-17F、IL-1β、IL-4、TNF-α和 TNF-β)和 CRP 的显著下降,具有统计学意义(P<0.05,配对 T 检验)。此外,病例 7 外周血 GM-CSF 水平在 2 周随访时保持在正常范围内(7.7 pg/ml、11 pg/ml、11.8 pg/ml,正常范围 0~39 pg/ml)。
研究结论
本研究为 GM-CSF 用于治疗伴有循环 CAR-T 细胞下降的中性粒细胞减少患者的临床可行性提供了证据。
好文章,需要你的鼓励