T 淋巴母细胞淋巴瘤(T-LBL)是儿童难治复发(R/R)淋巴瘤中的常见类型,也是临床上一大难啃的「骨头」。近年来随着分层治疗理念的深入、联合治疗方案的应用,R/R T-LBL 的治疗疗效得到了明显提升。
在近期召开的「高博医学论坛·中国免疫及靶向治疗高峰论坛暨第四届淋巴瘤&骨髓瘤国际高峰论坛」上,高博医学(血液病)北京研究中心北京高博博仁医院刘英主任分享了一例儿童 R/R T-LBL 病例,并系统回顾领域内经典研究,以实践结合循证,诠释了分层联合治疗策略带来的临床获益。
病例分享
原发难治 T-LBL,一线化疗期间疾病进展
患儿为 5 岁男孩,2020 年 12 月以双颈部淋巴结进行性肿大起病,全身广泛受累。2021 年 1 月在外院确诊为 T-LBL(Ⅲ期,CNS1,中危组),治疗经过如下(图 1)。
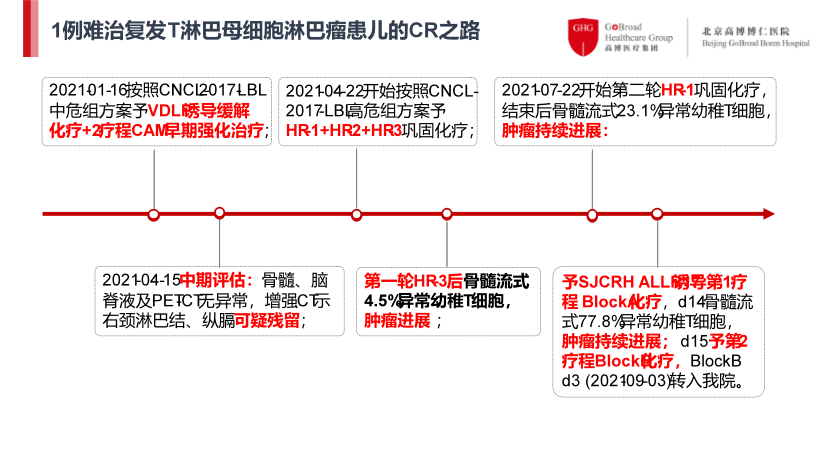
自一线巩固化疗起,患儿疾病持续进展,原发难治,于 9 月转入北京高博博仁医院。
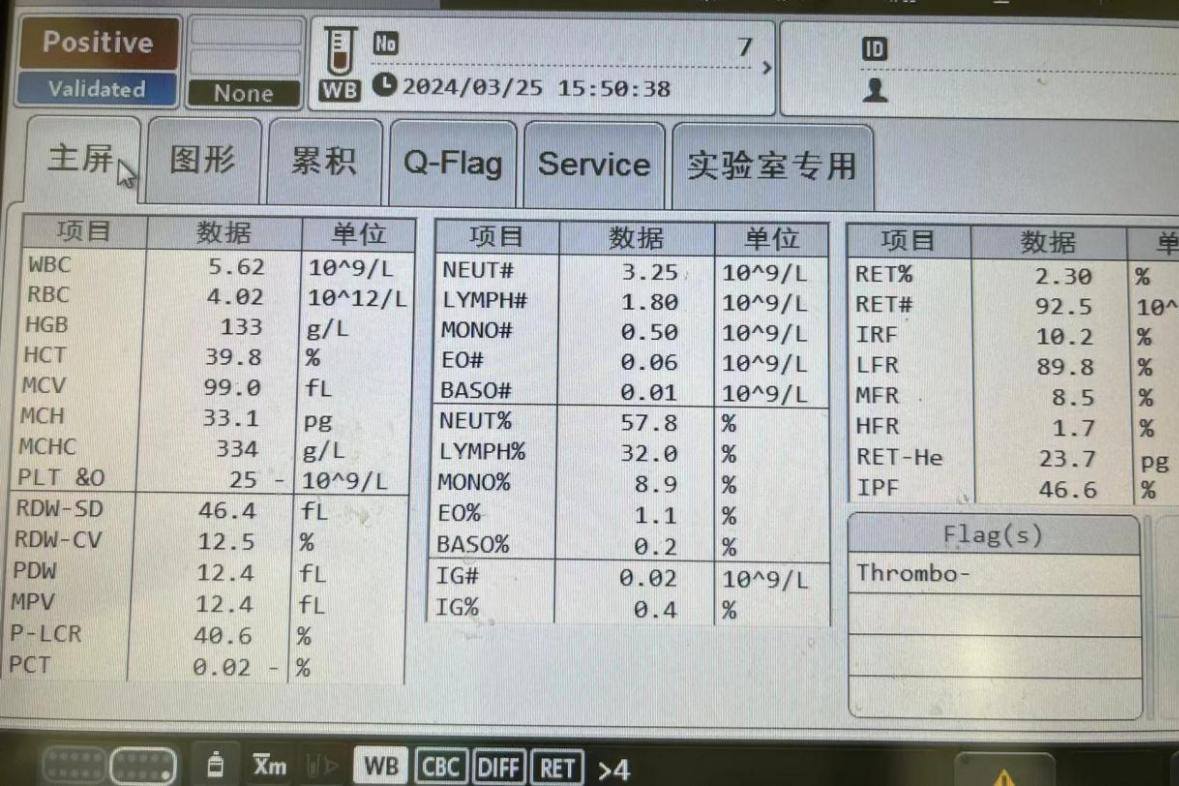
转入后经全面评估,修正诊断为 T-LBL/急性 T 淋巴细胞白血病(T-ALL)(Ⅳ期,CNS1),各项评估结果如下。

供者 CD7 CAR-T 桥接 allo-HSCT,获持续 CR
患儿入院检查期间,继续接受 BlockB 化疗,并于 d8 增加了 1 剂柔红霉素,d28 评估达部分缓解(PR)。至此,医学团队考虑,该患儿在一线化疗中即出现肿瘤进展,二线诱导化疗仅达 PR,提示其对化疗高度耐药,继续化疗无缓解可能,难以达到造血干细胞移植(HSCT)条件,故决定先行嵌合抗原受体 T 细胞(CAR-T)桥接治疗。
靶点选择方面,鉴于患儿初诊时和进展后再次评估,肿瘤细胞均高表达 CD7,CD7 是合适的靶点。患儿目前残余肿瘤负荷仍较高,自体来源 CAR-T 中可能混合肿瘤细胞;且经连续强烈化疗后,患儿外周血 T 细胞数量和质量有限,培养成功率低,制备污染和制备失败风险均较高。
而患儿正好有一位人类白细胞抗原(HLA)全相合同胞供者,因此,供者来源 CAR-T 是更为理想的选择。
HLA 全相合供者 CAR-T 能够不受 HLA 限制,回输后可直接识别表达 CD7 的肿瘤细胞和正常淋巴细胞,快速活化扩增、快速植入,发挥细胞毒 T 细胞的杀伤功能,可理解为自带清淋功能。
但同时,CD7 为组织特异性肿瘤相关性抗原,CD7 CAR-T 杀伤恶性 T 细胞时可能误杀正常 T 细胞,导致 T 细胞免疫功能缺陷,增加严重感染风险;另一方面,供者嵌合状态也增加了移植物抗宿主病(GVHD)发生风险,这些风险都需要在临床实践中注意。
鉴于患儿携带 STAT5B 基因变异,减积化疗中可联合 JAK 抑制剂靶向治疗,非特异性靶点 BCL-2 抑制剂也在临床研究中显示了增效价值。
经 CAG 化疗联合芦可替尼+维奈克拉减积治疗(5 天)和环磷酰胺+氟达拉滨清淋预处理(2 天),为疾病稳定(SD)状态,之后回输 HLA 全相合同胞供者 CD7 CAR-T。
回输后 d11,患者外周血和骨髓均检测不到 CD7+T 淋巴细胞、且达 80% 以上供者嵌合,为了防止出现 GVHD,在完全缓解(CR)后需尽快桥接异基因 HSCT(allo-HSCT),一般在回输后 30 天内。故 d19 开始 HSCT 预处理,之后顺利完成 HLA 全相合同胞供者 allo-HSCT,持续 CR 已 8 月余。
优化二线化疗、联合靶向治疗,奠定成功关键
回顾患儿自疾病进展至 CAR-T 回输的 12 周内,先后使用了 HR-1、BlockA、 BlockB、CAG+靶向药物、环磷酰胺+氟达拉滨化疗,严重粒细胞缺乏持续 6 周,给后续 CAR-T 和 HSCT 带来了极大感染风险。
对于高肿瘤负荷患者,CAR-T 治疗前若不予足够强度化疗,CAR-T 治疗期间容易合并严重 CRS 反应;若伴有大瘤灶存在,瘤灶对 CAR-T 细胞的反应比骨髓慢,而随着 CAR-T 细胞在体内扩增时间延长,感染加重、GVHD 发生,患者不得不在瘤灶没达 CR 时强行移植,不仅增加移植风险而且影响长期无病生存。
尽管此患者在 CAR-T 前的化疗中如履薄冰,但终究将肿瘤负荷降到相对安全的程度,使得 CAR-T 回输后骨髓快速缓解并顺利桥接 allo-HSCT。
由此总结,对于 R/R T-LBL 患者,尤其是高肿瘤负荷者,优化二线化疗方案并联合靶向药物治疗是 CAR-T 和 HSCT 成功的关键。
儿童 R/R LBL 分层治疗策略解读
几大国际方案中危组疗效相当,长期 EFS 率 60%~70%
对于儿童 R/R LBL,基于复发部位和复发时间的危险度分组进行分层化疗是目前国内外公认的标准策略。具体方案的探索上,国际上几大权威的儿童血液系统肿瘤诊治协作组开展的一系列经典临床试验提供了高级别循证证据。
英国 UKALLR3 研究入组了 212 例儿童复发 ALL,80% 以上为中危组,其中急性 B 淋巴细胞白血病(B-ALL)188 例、T-ALL 24 例。结果显示,米托蒽醌组疗效显著优于去甲柔红组,3 年无进展生存(PFS)率和总生存(OS)率均大幅提高(64.6%vs35.9%,69.0%vs45.2%)。
美国儿童肿瘤协作组(COG)AALL0433 研究入组 271 例儿童中危组复发 B-ALL,包括晚期骨髓复发和极早期中枢复发。3 个周期诱导化疗后,有 HLA 全相合亲缘供者行 HSCT,否则继续完成诱导后治疗。3 年无事件生存(EFS)率和 OS 率分别为 63.6% 和 72.9%。
德国 ALL-REZ BFM 2002 研究入组 208 例儿童中危组复发 ALL,诱导化疗结束 MRD ≥ 10-3 者 8 年 EFS 率和 OS 率分别为 64% 和 68%,MRD<10-3 者分别为 70% 和 73%。
UKALLR3 和 ALL-REZ BFM 2002 的合并分析中,共纳入 136 例儿童高危组复发 B-ALL 和 257 例 T-ALL,10 年 EFS 率分别为 22.6% 和 26.2%,10 年 OS 率分别为 32.6% 和 28.2%;移植后高危复发 B-ALL 的 10 年无病生存(DFS)率和 OS 率分别为 42.1% 和 56.8%,T-ALL 分别为 51.6% 和 55.4%。
可以看到,上述几种国际方案对儿童中危组复发 ALL 的疗效相当,长期 EFS 率在 60%~70% 这一水平,但高危组仅在 50% 左右。
新型靶向药物加入二线治疗,儿童 R/R T-LBL 疗效迎来突破
各类靶向药物的问世,为儿童 R/R T-LBL/ALL 二线治疗方案的优化带来了希望。T-ALL 现有治疗靶点包括:IL-7-JAK-STAT、PI3K-AKT-mTOR、RAS-MAPK、NOTCH 信号通路、细胞周期调节、CAR-T 靶点 CD5/CD7 或单抗靶点 CD38 等特异性靶点;抑制 BCL-2、蛋白酶体和 DNA 合成的非特异性靶点。其中 CDK4/6 抑制剂、mTOR 抑制剂、BCL-2 抑制剂、CD5 CAR-T、CD38 单抗、蛋白酶体抑制剂均已有相应的临床研究数据支持。
英国 UKALLR3 系列研究中,硼替佐米联合 VDLM 诱导化疗将儿童 R/R ALL 的 CR2 提高至 80%。美国 COG AALL07P1 研究中,硼替佐米联合 VDLP 诱导化疗将儿童 R/R T-ALL 的 CR2 提高至 68%。
北京高博博仁医院儿童淋巴瘤科在张永红教授带领下,基于国际标准方案,结合团队临床经验,针对儿童 R/R T-LBL 建立了全程的分层联合治疗体系,在实践中显示了良好获益,使更多患儿获得了高质量深度缓解。前文分享的难治 T-LBL/ALL 病例也正是在这一体系理念指导下进行的成功实践,希望能为同道带去一定的启发和帮助。
专家点评:
张永红教授:儿童 T 淋巴母细胞淋巴瘤为儿童时期第二常见的淋巴瘤类型,也是目前临床疗效最差的儿童淋巴瘤类型之一。复发难治的 T 淋母更是极具挑战性,如何更深入地认识 T 淋母淋巴瘤的生物学特征,找到更有效的治疗方式是我们目前的主要研究方向。
UKALLR3 系列研究中硼替佐米联合化疗可以明显提升疗效,给了我们很多启示:通过分子检测找到肿瘤发生发展和逃逸的路径,了解真正的预后因素,从而进行分子分层指导下的个体化的靶向治疗,从而获得更好的疗效。
此外,CAR-T 治疗也给难治复发病人带来再次缓解的希望,虽然有成功的案例,但是 T 细胞 CAR-T 较 B 细胞 CAR-T 有更多需要解决的难点和问题。我们相信科学的力量无穷,只要有了方向,经过努力,一定会达到目标。
科学的进步让我们对淋巴瘤有了更多的认识,也从免疫靶向治疗中获益。相信不久的将来会有更多突破性进展,「战胜淋巴瘤,我们一起努力」!
好文章,需要你的鼓励