弥漫大 B 细胞淋巴瘤 (DLBCL) 是淋巴瘤中最常见的类型,利妥昔单抗联合以蒽环类药物为基础的免疫化疗方案使超过半数的患者获得长期生存和治愈。
然而,免疫化疗原发耐药和缓解后早期复发(小于 12 个月)的患者死亡率极高,是临床上的重大挑战,对蒽环类药物的耐药是这些患者不良预后的重要因素之一。因此,只有揭示其发生机制,才能发现改善蒽环类药物治疗效果的新方法。

日前,河南省肿瘤医院 临床研究管理部主任、内科副主任刘艳艳带领的淋巴瘤研究团队,与病理科夏庆欣主任团队,分子病理科郭永军主任、马杰主任团队,中美 (河南) 荷美尔肿瘤研究院合作,首次揭示了 MiRNA-363-3p/DUSP10/JNK 信号通路在弥漫大 B 细胞淋巴瘤 (DLBCL) 化疗耐药中的机制。
目前该研究成果已以《MiRNA-363-3p/DUSP10/JNK Axis Mediates Chemoresistance byEnhancing DNA Damage Repair in Diffuse Large B-cell Lymphoma 》(《MiRNA-363-3p/DUSP10/JNK 信号通路通过增强弥漫大 B 细胞淋巴瘤 (DLBCL) 的 DNA 损伤修复介导化疗耐药》)为题在血液学顶级期刊 Leukemia 发表(影响因子 11.5)。
该研究基于蒽环类药物的化疗耐药作为 DLBCL 治疗中的主要挑战之一,为揭示蒽环类药物化疗耐药的机制,本研究团队通过分析 miRNA 和 mRNA 表达谱(来源于 47 例接受 R-CHOP 方案治疗的 DLBCL 病人石蜡标本,其中 16 例耐药,31 例敏感)发现,miRNA-363-3p 的高表达与化疗耐药及不良预后独立相关,且这一相关性也在验证集(106 例标本)中通过实时荧光定量 PCR 得以证实。
与此同时,miRNA-363-3p 过表达及 CRISPR/Cas9 介导的 miRNA-363-3p 敲除 DLBCL 细胞系体外体内实验也证实,miRNA-363-3p 高表达与阿霉素诱导的细胞凋亡及移植瘤肿瘤缩减负相关。
随后,表达调控机制研究证实,miRNA-363-3p 的表达与其启动子中 E-box 位点(MYC 结合位点)的甲基化程度负相关。进一步的靶基因预测及荧光素酶实验证实,耐药组中低表达基因-双特异性磷酸酶 10(DualSpecificity Phosphatase 10, DUSP10)为 miRNA-363-3p 的下游调控靶点之一。
与此同时,DLBCL 细胞体外实验证实,miRNA-363-3p 通过下调 DUSP10 表达进而导致 c-Jun N-末端激酶(JNK)磷酸化(p-JNK)的增加,而 p-JNK 的增加则与 DNA 双链断裂(Double Strand Break,DSB)异常修复相关。同时,mRNA 表达谱基因聚类分析也发现 DSB 修复相关信号通路的富集。
进一步,体外 DSB 修复通路分析及免疫荧光实验证实,miRNA-363-3p/DUSP10/JNK 信号通路可通过抑制同源重组(Homologous Recombination,HR)修复从而增强非同源末端连接修复(Non-Homologous End Joining,NHEJ)的方式,介导 DLBCL 细胞更加高效的修复阿霉素诱导的 DSB,从而导致阿霉素耐药。
在此基础上,通过靶向 JNK 和多聚 ADP 核糖聚合酶 1(poly(ADP-ribose) polymerase 1,PARP1),在体外体内实验中,逆转了 miRNA-363-3p/DUSP10/JNK 信号通路诱发的阿霉素耐药,并延长了荷瘤小鼠的生存期。
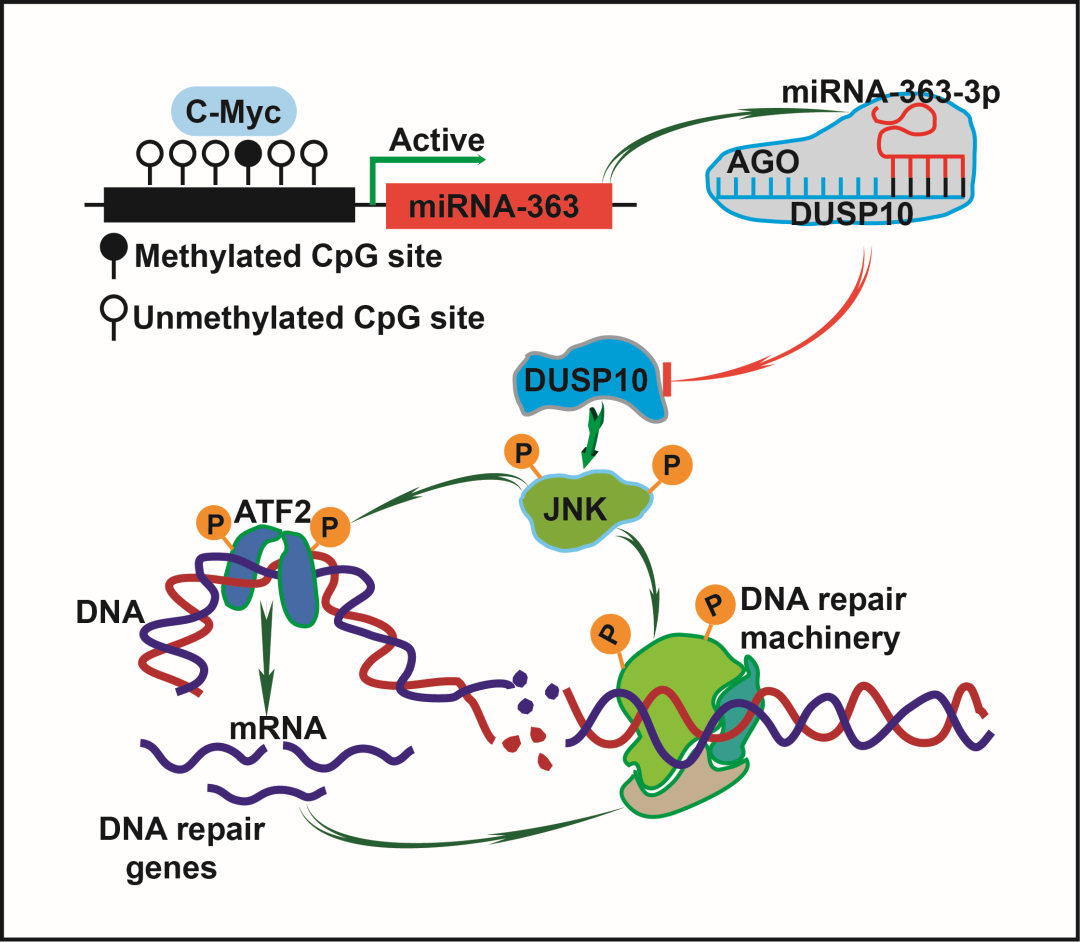
综上所述,本研究团队发现了 miRNA-363-3p/DUSP10/JNK 信号通路通过增强 DLBCL DNA 损伤修复介导化疗耐药的新机制,并初步探讨了靶向该通路可逆转其介导的 DLBCL 耐药的方法。
刘艳艳主任为本论文的通讯作者,夏庆欣主任为本论文的共同通讯作者,周文平、徐原林、张培培、张九阳博士为共同第一作者。该研究得到国家自然科学基金青年及面上项目、河南省中原千人计划、我院创新团队、苗圃科研基金项目等经费支持。
好文章,需要你的鼓励