据统计,小肠癌腺癌年发病率约为 2.2~5.7/10 万人,平均发病年龄在 50 岁以上,最好发于十二指肠,约占一半以上。虽然近年来小肠癌发病率呈上升趋势,但仍较为少见。小肠癌起病隐匿,无特异性症状和体征,确诊时多已是晚期。尽管内镜检查手段不断进步(如小肠镜和胶囊内镜等),但早期诊断仍困难重重。
据统计,小肠癌腺癌年发病率约为 2.2~5.7/10 万人,平均发病年龄在 50 岁以上,最好发于十二指肠,约占一半以上。虽然近年来小肠癌发病率呈上升趋势,但仍较为少见。小肠癌起病隐匿,无特异性症状和体征,确诊时多已是晚期。尽管内镜检查手段不断进步(如小肠镜和胶囊内镜等),但早期诊断仍困难重重。
以往,小肠癌治疗选择与大肠癌(结直肠癌,CRC)相同,直到去年才有专门的小肠癌 NCCN 指南。小肠癌在遗传学上与大肠癌明显不同,可将二者区分,并可为新的靶向治疗或免疫治疗提供依据。
2019 年 10 月的一个夜晚,70 岁的吕先生因上吐下泻进了医院,自以为是吃坏了肚子,用点抗生素就好了。但血常规却提示:肿瘤标志物 CA199 异常升高,突破 1000(正常范围 0-30.9)。进一步行 PET-CT 检查发现:十二指肠球部及降段壁增厚,PET 显示异常放射性浓聚,考虑为恶性,并且回盲部、腹盆腔腹膜、肝门区均有转移迹象。后经消化道内镜及病理活检,明确诊断为「十二指肠腺癌伴腹腔多发转移」,基因检测发现与小肠癌密切相关的 KRAS G12D 突变。
确诊后,吕先生开始了为期 3 周期的 FOLFOX 方案化疗。其间,医生试图进行十二指肠支架置入术,但因幽门僵硬狭窄难以通过,遂改用胃镜下丝线辅助营养管置入到十二指肠降段,另置入胃管至胃体。第一周期化疗后,吕先生肿瘤标志物 CA19-9 不降反升,医生决定调整方案,改用化疗联合免疫治疗(伊立替康 +帕博利珠单抗)。经过三个疗程后,吕先生出现了严重的骨髓抑制,之后医生减少了伊立替康用量,并联合抗血管生成抑制剂(VEGF 抑制剂)阿帕替尼治疗。
今年 3 月,疫情刚好转,吕先生却出现了明显的腹胀、腹水,腹水中检测到腺癌细胞。他接受了数次贝伐珠单抗腹腔灌注治疗,但情况依然不乐观,近两个月还曾因意识不清被紧急抢救,目前主要依靠肠外营养等对症支持治疗。
治疗遇到瓶颈之时,吕先生的家人觉得有必要听听国内外其他专家的意见,看看是否还能找到治疗突破口,以更好地控制病情。于是,他们通过院内好医友国际医疗中心预约了中美远程会诊。
中美远程会诊:美国专家全面剖析小肠癌治疗
通过好医友中美远程会诊平台,吕先生的家人视频连线了美国肿瘤科专家迈克尔·卡斯特罗 (Michael Castro) 博士,他曾多次被《美国新闻和世界报道》评选为「美国顶级医生」,深耕肿瘤治疗和研究 20 余年。针对吕先生的病情,卡斯特罗博士进行了深入的分析,并解答了关于治疗的一系列具体问题。

好医友医疗网-肿瘤专家 Michael Castro 博士
1. 过早停止初始化疗方案 FOLFOX,或非明智之举
卡斯特罗博士:FOLFOX 治疗后,肿瘤细胞死亡并释放 CA19-9 进入血液时,血清肿瘤标志物通常会出现升高,这是治疗受益的第一个标志。但是,血清肿瘤标志物的升高也可能提示治疗失败,因此临床医生经常被该肿瘤标志物所误导。通常情况下,至少需要在两个月内频繁监测肿瘤标志物,以明确治疗是否有效。
患者的主治医生可能就是因 CA19-9 指标的升高从而判断 FOLFOX 治疗无效。随后调整治疗方案为伊立替康联合 VEGFR 抑制,但疗效也似乎不太理想。由于当时没有行后续的影像学检查以评估 FOLFOX 的疗效,因此,并不能确切判断伊立替康治疗后疾病是否进展。但伊立替康治疗后 CA242 升高引发了我对过早停止化疗的担忧,铂类化疗维持时间过短。
2. VEGF 抑制剂若用药过猛,可能加剧问题
卡斯特罗博士:由于肿瘤很坚硬,内镜医师无法置入十二指肠支架,这可能表明该肿瘤是增生性的。在这种情况下,由 TGF-β激活的成纤维细胞将纤维蛋白沉积到肿瘤微环境(TME)中,从而形成一种刚性且灌注不良的癌症,阻止了化疗药物到达肿瘤或免疫细胞进入肿瘤。此外,增生性癌症往往倾向于缺氧且出现 HIF1A 上调。
然而,使用 VEGF 抑制剂可能进一步加剧这一问题。因此,低剂量的 VEGF 抑制剂可能比高剂量具有更好的化疗效果。根据我个人的临床经验,建议使用低剂量贝伐珠单抗,每两周一次,不额外增加剂量。此外,抗高血压药物氯沙坦通过抑制 TGF-ß的脱靶作用,在中和结缔组织增生方面具有显著作用,可结合使用。
3. 信号通路影响分析——KRAS 突变
卡斯特罗博士:RAS 是一种癌基因,能够上调导致恶性表型的细胞内途径,包括不受控制的增殖、细胞凋亡的阻断(正常细胞死亡)、免疫逃逸、代谢改变等。RAS 蛋白,包括 KRAS,通过分别与鸟苷二磷酸 (GDP) 和鸟苷三磷酸 (GTP) 结合,在非活性(「关闭」状态)与活性(「开启」状态)之间切换。
KRAS 突变导致 PI3K>AKT 通路的上调是耐药的主要发生机制。患者癌症中的 FAT1 和 EPHA7 突变也会导致 PI3K>AKT 通路信号的上调。据此,我们可以考虑通过重新应用奈非那韦(现已被公认为 AKT 抑制剂)探索其他化疗疗法。
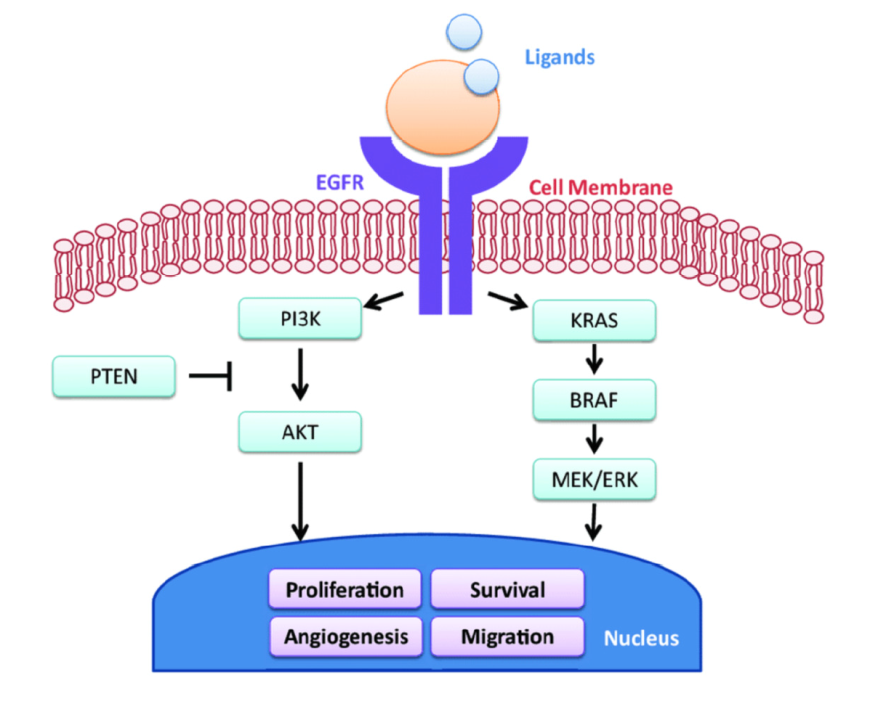
图:KRAS 突变引起的通路激活
患者存在 G12D 突变,而该突变目前尚无对应的靶向药物。但由于 KRAS 激活依赖于 GTP 与 SOS1 的 GDP 交换,因此,SOS1 抑制剂对所有 KRAS 突变均有疗效。目前有多个 SOS1 抑制剂正在临床试验中,如 BI1701963 和 BI3406 以及 BAY-293。
MEK 在信号转导级联中位于 KRAS 的下游。因目前尚无可用的 KRAS 抑制剂,因此可尝试使用曲米替尼或考比替尼等药物阻断 MEK 来中和 KRAS 信号传导。两种经 FDA 批准的药物曲美替尼和 ZOL 的联合应用,代表了一种治疗 KRAS 突变型癌症的新策略。
4. 调整治疗策略,尝试免疫疗法与靶向治疗
卡斯特罗博士:尽管以往化疗是提高生存率的唯一手段,但我们现在有了新的免疫疗法、靶向治疗可供选择。鉴于到目前为止,化疗似乎没有太大帮助,我倾向于使用免疫治疗药物帕博利珠单抗联合瑞戈非尼,或是帕博利珠单抗联合玻玛西林,同时结合 DCA(如果 LDH 或乳酸升高)、烟酸、己酮可可碱和地诺单抗进行治疗。此外,如果能获取组织进行 RNA 测序/基因表达分析和 MHC1 IHC 染色,可有助于了解癌症免疫逃逸的确切机制,并通过参加新药临床试验解决这一问题。
靶向治疗方面,首先考虑靶向 KRAS 策略:包括使用异戊烯化抑制剂(联合吉西他滨+紫杉醇),并将肝动脉输注唑来膦酸联合 MEK 抑制剂作为挽救性方案,以及考虑「MEK +自噬抑制剂」的「合成致死」治疗方案。其次是靶向 PI3K 策略(包括使用 I3C 、奈非那韦、二甲双胍)和靶向 TP53 策略,可关注 SOS1 抑制剂,以及 Adavosertib 和 APR-246 的临床试验。
其他方面,还包括避免使用质子泵抑制剂 (PPIs);评估 D-二聚体;避免补充胰酶引起的脂肪泻;优化体内维生素 C、维生素 D、铁、硒和炎症水平等。
通过会诊,吕先生收获了有价值的国际第二诊疗意见,也在治疗上找到了突破口。
(注:好医友中美远程会诊案例的相关治疗建议,均为个案个例,不适用于该患者之外的其他人。所有的临床治疗务必遵循医师指导。)
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
好文章,需要你的鼓励
推荐阅读
















