多发性骨髓瘤(multiple myeloma,MM) 是血液系统第二大恶性肿瘤,好发于老年人,其特征为恶性浆细胞不可控的进展性增生。该病可降低患者对感染的抵抗力,造成严重骨病(伴有骨痛、病理性骨折和
多发性骨髓瘤(multiple myeloma,MM) 是血液系统第二大恶性肿瘤,好发于老年人,其特征为恶性浆细胞不可控的进展性增生。该病可降低患者对感染的抵抗力,造成严重骨病(伴有骨痛、病理性骨折和高钙血症)、贫血、肾功能衰竭、神经并发症和高粘滞综合征,而疾病的进展将最终导致死亡。
骨髓瘤的治疗疗效不断提升
我国每年新增至少 6 万例多发性骨髓瘤患者,大多数患者生存期仅 3-5 年。
近年来,一方面,随着蛋白酶体抑制剂(硼替佐米为代表)、新免疫调节剂(来那度胺为代表)、单克隆抗体(CD38 单抗)等新药的出现,多发性骨髓瘤患者的治疗效果及生存期得到了很大的提高,10 年以上的生存成为更多骨髓瘤治疗中心的治疗目标;
另一方面,随着对多发性骨髓瘤的不断深入研究,对其分子机制的了解,对患者的预后判断更加准确,进一步指导了骨髓瘤患者的精准治疗。
难治复发型骨髓瘤治疗仍然面临挑战
然而,尽管如此,仍有部分极高危的患者,肿瘤突破了一道又一道治疗防线,最终发展成为复发难治的类型,其中进展最快。恶性度最高的是:浆细胞白血病,也就是骨髓瘤细胞广泛侵犯骨髓,乃至大量释放入血液,在血液中就能检测到大量恶性浆细胞。
不少浆细胞白血病是从前期经过多线治疗后耐药的多发性骨髓瘤发展而来的,而且往往还携带有两个以上特定的恶性遗传学特征,被称为「双打击」,因此治疗极为困难,进展期的浆细胞白血病往往发展数月即可产生致命风险。
治疗案例
近日北京博仁医院接诊到一例七线治疗及自体造血干细胞移植后的难治复发进展期浆细胞白血病患者。患者既往经过正规的治疗,但从未完全缓解。面对这样进展迅速,肿瘤恶性度高的患者,该如何选择下一步治疗?
确诊,规范化治疗效果差
患者,女,35 岁,2 年余前(2018-8)无明显诱因出现进行性加重的骶髂关节疼痛、乏力。2018-11 至昆明医科大学第二附属医院,完善检查:IgG 110.00 g/L,λ轻链 119.0 g/L。
血清及尿免疫固定电泳均提示:IgG-λ型 M 蛋白。骨髓细胞学示:浆细胞异常增生。流式细胞分型: 异常浆细胞 13.41%,符合浆细胞肿瘤表型;外周血异常浆细胞 14%;骶椎平扫示:骶椎、腰椎、髂骨多发病变。考虑诊断「多发性骨髓瘤 IgGλ型 DS 分期 Ⅲ期」。
转入我科,入院评估
入科后患者乏力明显,未诉明显骨痛。查体可见面色苍白,呈中度贫血貌。心肺腹查体尚无异常体征。
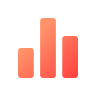
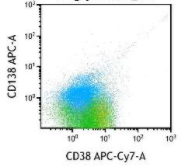
血常规提示:白细胞 3.06*10^9/L ,血红蛋白 71 g/L ,血小板 25*10^9/L,血生化显示:肌酐 59.5umol/L,白蛋白 32.1 g/L,球蛋白 60.2 g/L,血钙 1.85 mmol/L;骨髓瘤相关检测:骨髓穿刺形态可见 69% 的骨髓瘤细胞(图 1),血涂片可见 28% 骨髓瘤细胞骨髓的流式细胞学分析可见 53% 骨髓瘤细胞,表达 CD38,CD138,CD56,BCMA,CS1(图 2)。
血清肿瘤相关的 M 蛋白和轻链蛋白也显著升高。染色体未见异常,FISH 示: 1q21 基因位点扩增阳性,IGH/MAF 基因位点融合阳性, 其余检测结果均为阴性。肿瘤靶向基因突变二代测序显示:TP53 ;KRAS;BRAF;SETD2;CYLD;PRDM1;ATRX;SRCAP;ANK2 变异。腹部 CT 示:左肋骨、右侧髂骨和骶骨骨异常,结合病史,符合多发性骨髓瘤表现。
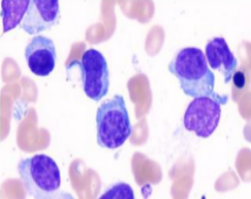
图 1
图 2
思考
患者治疗过程为何如此艰难?
患者是一例较少见的青年发病的骨髓瘤,起病时肿瘤负荷就较重,分期较晚。前期确诊后的治疗先后经历了硼替佐米为核心,来那度胺为核心的规范的多药联合治疗,疾病虽然在一定程度上得到了控制,但缓解深度始终不够。后续在多次多线化疗后达到部分缓解的情况下,为了进一步获得深度缓解,进行了自体造血干细胞移植。
整体来看前期治疗比较规范。然而移植后在巩固维持治疗的前提下,疾病仍然出现复发进展,说明肿瘤的耐药特点突出。随后患者采用了 CD38 单抗联合泊马度胺的新药联合治疗,疾病依然持续进展。
患者入院时已出现肿瘤快速进展,高肿瘤负荷,外周血出现大量骨髓瘤细胞,达到了浆细胞白血病的程度。入院后的检测发现,患者肿瘤细胞具有很多高危的生物学特征,包括染色体的异常(1q21 扩增,IgH/MAF 融合)、基因突变(TP53,KRAS,BRAF 等),这一系列的异常特征或可解释患者如此艰难的治疗过程。
患者下一阶段的治疗该如何选择?
最近数年,随着多发性骨髓瘤的研究不断深入,治疗手段也有了一些新的突破。除了令人瞩目的 CD38 单克隆抗体(达雷妥优单抗)的出现,另一重大进展就是 BCMA-CAR-T 细胞免疫治疗。其他新药例如 CS-1 单抗(埃洛妥珠单抗),核输出蛋白抑制剂(XPO1)等,但整体疗效不如 CD38 单抗和 BCMA-CAR-T。
BCMA 是特异性表达在浆细胞,浆母细胞,活化 B 细胞表面的蛋白分子。多发性骨髓瘤作为一种浆细胞肿瘤,也会表达 BCMA,因此成为 CAR-T 细胞治疗的目标靶点。尽管国内外,BCMA CAR-T 治疗骨髓瘤均处于临床试验阶段,但就目前报道的数据来看,其有效率在 70% 以上,而且很多患者可以达到完全缓解。
因此这一疗法成为继 CD19 CAR-T 治疗 B 细胞淋巴瘤/白血病之后近期最有希望上市的细胞免疫疗法。北京博仁医院的这位患者由于前期已经采用了 CD38 单抗治疗且疾病仍然进展,因此目前最有希望的治疗方法就是 BCMA-CAR-T 治疗。然而,本例患者如果选择 BCMA-CAR-T 细胞治疗还面临以下困难:
①骨髓瘤进展至浆细胞白血病阶段,单纯 CAR-T 治疗后复发率高,该患者年轻,实现长远治愈难度大
②目前肿瘤负荷重,疾病进展迅速,在等待 CAR-T 细胞制备之前疾病可能危及生命
③高肿瘤负荷 CAR-T 治疗时可能发生严重的不良反应
④血液中肿瘤细胞过多,严重影响淋巴细胞采集,根本无法制备 CAR-T 细胞
千思万虑,运筹决策
根据患者上述情况,我们中心经过讨论,制定了以下治疗策略:以治愈疾病为目标,前期通过化疗联合 BCMA CAR-T 细胞治疗争取最大程度的缓解,后期桥接异基因造血干细胞移植。
具体计划:
第一步,新药方案化疗,控制肿瘤进一步进展,减低肿瘤负荷来提高 CAR-T 治疗成功率,降低风险;
第二步,从患者既往移植医院调取当年移植时剩余的造血干细胞,利用造血干细胞采集物中的淋巴细胞培养 CAR-T 细胞。可以解决目前患者无法采集淋巴细胞的问题。
第三步,积极处理 CAR-T 细胞治疗中可能出现的溶瘤综合征,细胞因子释放综合征,神经毒性,感染等并发症。第四步,积极进行异体造血干细胞移植的供者筛选和体检,为桥接移植做准备。
进入治疗,争分夺秒
患者入院前在北京朝阳医院就诊,朝阳医院骨髓瘤专家建议给予卡非佐米/泊马度胺/地塞米松联合化疗。入北京博仁医院后,我们评估这一方案一定程度上控制了肿瘤进展,认为有效,适合作为 CAR-T 治疗前的桥接化疗,于是继续进行了这一疗程该方案的化疗。化疗后患者外周血浆细胞从 28% 降至 11%。
由于患者血里浆细胞仍高,并且刚接受地塞米松治疗,淋巴细胞功能和数量都不适合采集来制备 CAR-T 细胞。
为了和快速进展的疾病争夺时间,在化疗同时就利用患者既往移植后剩余的干细胞采集物,应用上海雅科生物科技有限公司提供的 BCMA 慢病毒载体,进行快速 BCMA-CAR-T 细胞制备。经过一周的培养,CAR-T 细胞制备完成,但是由于患者剩余造血干细胞中的淋巴细胞较少,且之前经过反复冷冻,所以 CAR-T 培养细胞数量较低,仅达到 1.1×104/kg,较常规输注剂量显著减低。
患者经过常规预处理化疗后,回输了所有的 BCMA-CAR-T 细胞。
CAR-T 细胞回输后,患者和治疗组医生都在密切观察体温变化,观察可能出现的细胞因子释放反应,期盼 CAR-T 如期扩增并发挥作用。然而,患者回输细胞后的一周内无明显发热,也没有细胞因子释放反应的迹象。随后进行的第 7 天的 CAR -T 细胞监测也证实,CAR-T 细胞并未扩增。
面对 CAR-T 细胞早期扩增不良,治疗面临失败的问题,我们治疗组开展讨论,并广泛查阅文献资料。有研究显示,骨髓瘤治疗相关的免疫调节药物:来那度胺、泊马度胺等有增强 CAR-T 细胞细胞因子释放,刺激 CAR-T 细胞扩增的作用。
峰回路转,柳暗花明
在与患者及家属充分沟通,取得信任和理解后,我们在患者 CAR-T 细胞输注后第 9 天,开始给予患者泊马度胺 4 mg 每日一次口服。患者口服泊马度胺第 4 天,开始出现发热,经检查基本排除感染后,考虑发热为 CAR-T 相关细胞因子释放综合征(CRS)。
患者最高体温达 40℃,监测 CAR-T 细胞出现了明显的扩增,细胞因子水平迅速升高,患者同时出现了轻度的低氧血症,综合 CRS 反应评级达 2 级。患者 CAR-T 细胞扩增,细胞因子分泌水平动态变化如图 3a,3b。随后经过非甾体类药对症治疗,患者 CRS 反应逐渐平息,治疗过程中没有出现 ICANS(免疫效应细胞相关的神经毒性综合征)。
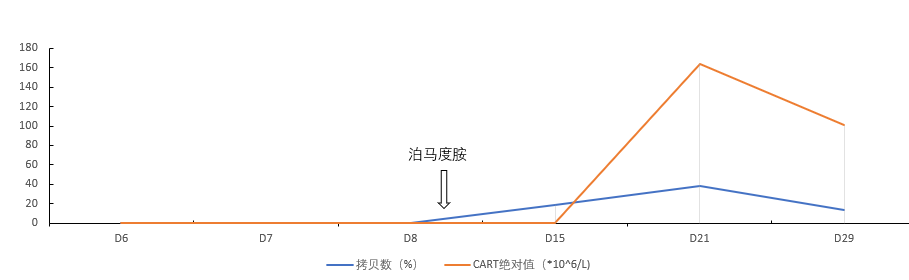
图 3a T 细胞抗原受体载体基因定量/CAR T 扩增趋势图
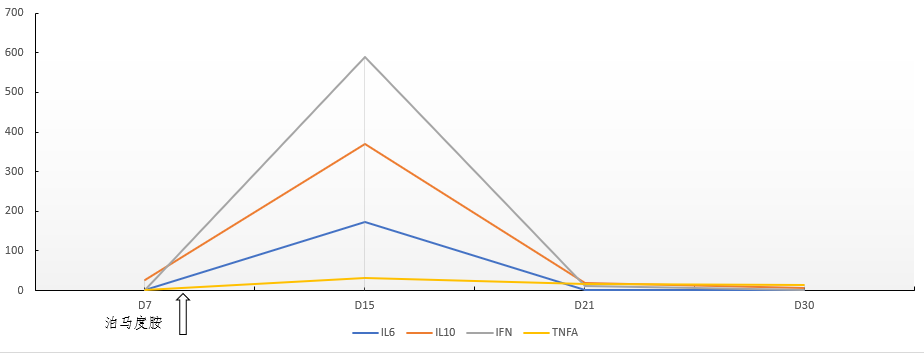
图 3b 细胞因子四项变化趋势图
患者接受 BCMA-CAR-T 治疗后 29 天,复查骨髓,外周血情况,形态学检查和流式细胞学检查提示肿瘤细胞均消失,治疗前后对比如图 4。患者骨髓瘤相关的 M 蛋白也显著下降。
综合评估,治疗后 60 天达到非常好的部分缓解(VGPR)。经过 1 月的休养,患者身体状况得到明显改善。目前完善了相关准备,患者顺利入移植仓,准备接受异基因造血干细胞干细胞移植,向治愈疾病进一步努力。
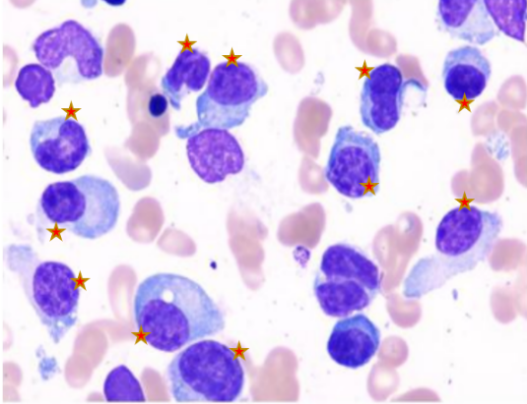
治疗前骨髓形态
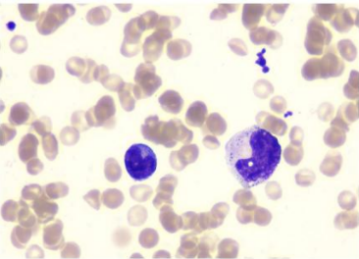
治疗后骨髓形态
注:★ 表示浆细胞

治疗前骨髓流式
治疗后骨髓流式
图 4 治疗前后骨髓形态及流式细胞检测(异常浆细胞消失)
写在诊后
本例患者初步治疗顺利结束。作为复发难治性多发性骨髓瘤继发浆细胞白血病来说,实属不易。患者最终治疗有效,主要得益于 BCMA CAR-T 细胞,但是目前浆细胞白血病 CAR-T 治疗仍面临一些困难,主要是外周血肿瘤细胞过多对淋巴细胞采集的影响和治疗后缓解期短暂,容易复发。
本例患者采用既往剩余的自体干细胞进行 CAR-T 培养获得成功,可以解决部分患者无淋巴细胞可用的问题。此外对于年轻患者,治疗后达到缓解期,桥接异基因造血干细胞移植,或可争取治愈。
本例患者在治疗中出现了 CAR-T 细胞数量不足,扩增不理想的问题。其实 CAR-T 治疗后对其作用进行调控一直是临床研究的重要问题:反应不足如何调强,反应过激如何消减,都值得进一步探索。
本例患者使用对免疫调节药物增强了 CAR-T 的反应,发挥了较好的疗效,同时这类药物对骨髓瘤本身也有治疗作用,这种方式为其他类似患者的治疗带来启发。
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
好文章,需要你的鼓励