虽然最近的临床试验已经证明 CD19 导向嵌合抗原受体 (chimeric antigen receptor, CAR)T 细胞治疗难治性或复发的 B 急性淋巴细胞白血病 (refractory or
虽然最近的临床试验已经证明 CD19 导向嵌合抗原受体 (chimeric antigen receptor, CAR)T 细胞治疗难治性或复发的 B 急性淋巴细胞白血病 (refractory or relapsed B acute lymphoblastic leukemia, r/rB-ALL) 的有效性,但大多数试验排除了高负荷 CNS 白血病 (central nervous system leukemia, CNSL) 患者,以避免严重神经毒性的风险。
仅有稀疏的病例描述了 CAR-T 细胞对低负荷 CNSL 的影响,而 CAR-T 细胞在高负荷 CNSL 中的安全性和有效性尚不清楚。找到有效的方案并开发新的策略来克服它是十分重要的。
我们团队回顾性分析了 12 例低负荷 (脑脊液中肿瘤细胞<20/μL) 或高负荷(脑脊液中肿瘤细胞 ≥ 20/μL 或有颅内大包块占位)的中枢神经系统白血病的 B-ALL 儿童 CD19 CAR-T 细胞治疗的结果,这些患者来自在高博医疗集团北京博仁医院开展的三项临床试验和一项同情性研究。
比较高负荷 CNSL 和低负荷 CNSL 在 CD19 CAR-T 细胞治疗期间的不良反应的区别,同时总结高负荷 CNSL 在 CD19 CAR-T 细胞治疗期间发生细胞因子释放综合征(cytokine releasing syndrome, CRS)和免疫效应细胞相关的中枢神经系统毒性(immune effector cell-associated neurotoxicity syndrome, ICANS)的相关临床处置。
从 3 项临床试验和 1 项预实验研究中,我们回顾性分析了 12 例儿童患者,他们年龄 1-12 岁,在 8-35 个周期的三次鞘内化疗失败后,中枢神经系统出现难治性 B-ALL。
12 名患者(2、3、5、6、8 和 11 号)中有 6 名(50%)CNS 复发 ≥ 2 次。3 例(25%)患者(3 号、6 号和 8 号)曾接受过头颅放疗。5 例(50%)患者(1 号、5 号、10-12 号)合并骨髓和 CNS 复发,其中 2 例(1 号和 5 号)移植后复发。
两名患者(1 号和 3 号)既往 CD19 CAR-T 细胞治疗失败。合并髓外疾病 2 例(17%),其中 1 例肾脏受累,6 例睾丸白血病。
预试验研究中的 7 名患者(编号 1-7)在入组时都有明显的神经症状。患者 1 有面瘫和截瘫。患者 4 有视神经占位性视力障碍,视力评定为双眼无光感。
患者 5 在注射前 18 天,MRI 发现面瘫和颞、枕叶占位性病变,并迅速发展为癫痫大发作(图 1B)。其他患者头痛严重,巴宾斯基征反射阳性。临床试验中 5 例(8~12 号)神经症状不明显,多表现为轻度头痛。
试验研究中的 7 名患者中只有 2 名(6 号和 7 号)的脑脊液浓度低于 5/µL,且无进一步进展。预实验中,3 名患者的 CNS 疾病仅在入组后暂时减轻,但在 CAR-T 扩增前迅速进展到>5/µL 的白血病细胞,这表明疾病非常难治。即使接受了三联鞘内注射药物和全身化疗,在回输 CAR-T 前,依然绝大部分的肿瘤仍处于 CNS3 状态。
临床试验患者在化疗后和 CAR T 细胞扩增前脑脊液中的冲击波峰值计数为 2(范围为 1-4)/μL,与预实验患者在化疗后和 CAR-T 细胞扩增前的峰值计数为 13(范围为 6-39)/μL,差异显著(P = 0.006)。也证明了预实验中的患者属于中枢大负荷肿瘤的患者。
CD19 CAR-T 细胞的中位输注剂量为 3.78(0.31~4.70)×106/kg。随着 CD19 CAR-T 细胞的扩增,所有患者脑脊液中的白血病逐渐减少(图 2A)。11 例(91.7%)患者在输注后第 30 天达到 CR/CRi,所有 CNS 症状减轻。患者 4 在第 30 天通过 MRI 检查获得部分缓解,但视力没有改善,3 个月后在没有其他治疗的情况下最终达到 CR。合并有骨髓和中枢神经系统疾病的 5 名患者在第 30 天也实现了骨髓 MRD 转阴。合并 EMDs 的 2 例患者在第 30 天病灶全部消失。
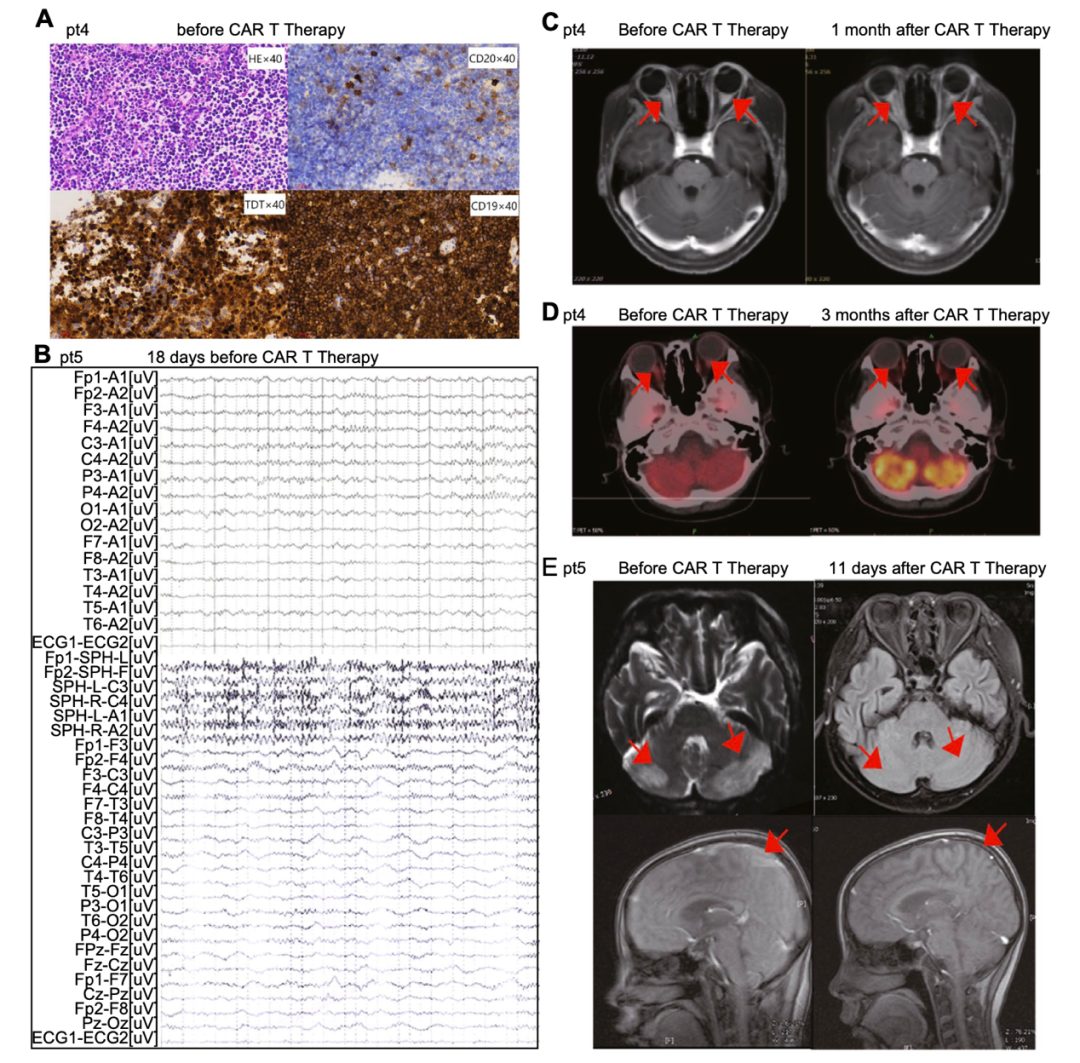
图 1
在 CAR-T 细胞输注后,常规监测 CRS 和 ICANS 临床表现。CRS 的中位发病时间为输注后第 5 天(范围 2~9),中位缓解时间为输注后第 14 天(范围 8~24)。
10 例(83.3%)无 CRS 或轻度(1~2 级)CRS,主要表现为发热(<40℃)和缺氧,需要低流量鼻导管吸氧(<6L/min)和其他支持治疗,包括退热药、静脉输液。CNS3 组仅有 2 例出现 3 级 CRS,表现为高热(>40℃),缺氧需要高流量吸氧(>6L/min)(图 2A 和 2B),我们同时监测每天液体量摄入和排出的失衡提示可能存在血管渗漏综合征(图 2D)。
12 例中 10 例(83%)ICANS 明显。ICANS 的中位发病时间发生在输注后第 5 天(范围 2-9),中位缓解时间为第 14 天(范围 8-24)。
部分患者(1-5、8、10、11 号)血压升高,可能反映颅内高压(图 2C)。5 例 CNS2(No.6、8、9、11、12)和 1 例 CNS3(No.1)对 CAR-T 细胞输注有反应,出现 1-2 级 ICANS,表现为定向、命名、服从命令、书写和注意等轻度异常。
2 例患者(9 号和 10 号)因囟门未闭,治疗期间出现了囟门隆起,提示颅内压升高。患者 9 在第 5 天也表现出轻微的注意力不集中,并用甘露醇治疗了 5 天。
大负荷中枢白血病患者 CNS3 组 5 例患者中 4 例(80%)出现严重 ICANS(3 级或 4 级),表现为脑水肿和癫痫发作,其中第 2 例和第 3 例 ICANS 最严重(4 级)。
患者 2 在第 2 天出现轻度注意力不集中,第 4 天发展为 4 级 ICANS,表现为呕吐、失明和颈部僵硬,第 2 天至第 13 天给予甘露醇和速尿以降低颅内压。鞘内注射了两次的 Dex,但其症状仍加重为危及生命的反复发作和昏迷。随后,静脉注射甲基强的松龙和托珠单抗来控制 CRS 和 ICANS。两天后患者视力恢复,其他症状均得到缓解。
他的治疗持续了将近两周。患者 3 在第 7 天发烧 40℃,第 5 天出现 3 级 ICANS,表现为严重呕吐和轻微的颈部僵硬。从第 1 天到第 17 天连续使用速尿和甘露醇。在第 7 天,出现了严重的抽搐,并接受了 4 个次的鞘内注射 Dex 治疗。他终于在第 18 天症状消失。有实性肿块的患者 4 和 5 出现 3 级 ICANS。
患者 4 的左眼及上下结膜红肿,眼球肿胀、压痛,第 4 天颈部强直轻度阳性。甘露醇和速尿治疗 3 天后,眼球肿胀明显减轻,随后颈部僵硬也有所减轻。患者 5 在第 6 天出现头痛,嘴角偶尔抽搐,并接受甘露醇和鞘内注射地塞米松治疗,但第二天仍出现左腿感觉神经不敏感。经过 12 天的治疗,她的 ICANS 降到了 1 级,最终在第 22 天得到解决。
ICANS 管理的详细原则见图 2F。
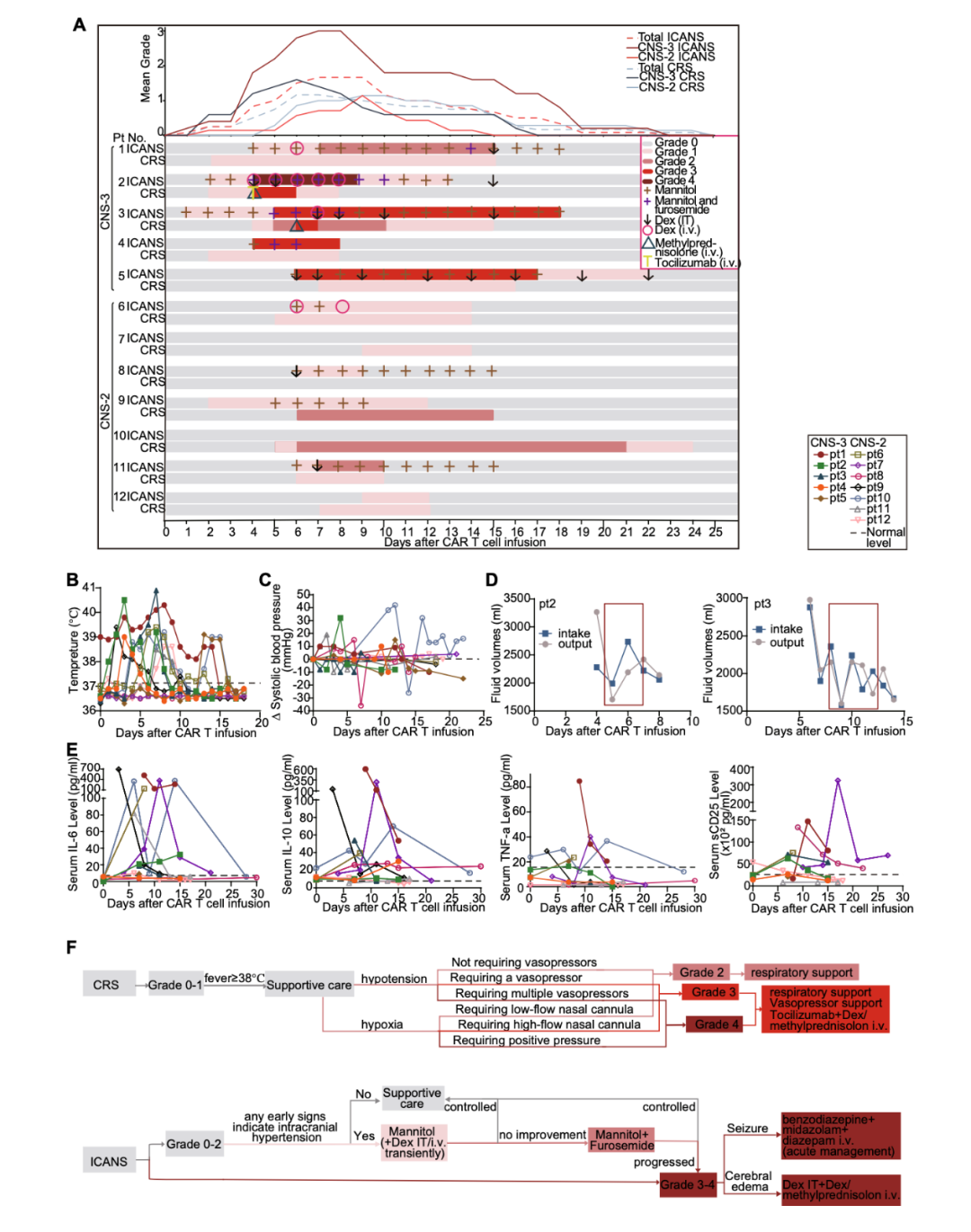
图 2
值得注意的是,CNS3 患者的 ICANS 明显比 CNS2 患者更严重和更持久(P = 0.002 和 0.006),但这两组的 ICANS 发病时间没有显著差异(P = 0.105)。
我们没有观察到有实性肿块的患者比没有实性肿块的患者有更严重的神经毒性,4 号患者的 ICANS 周期似乎更短,患者的两条视神经中有实性肿块,但脑脊液中没有白血病细胞(P = 0.251)。
患有 4 级 ICANS 的患者 2 和 3 的 CSF 中 CAR-T 细胞的峰值扩增高于其他患者,这意味着 CSF 中 CAR-T 细胞的扩增可能与神经毒性有关,但这种差异没有达到统计学意义,可能是由于入组病例的数量有限(P = 0.645)。
严重 ICANS 与较高的输注细胞剂量无关,即使在接受极低剂量 CAR-T 细胞的患者 5 中也观察到严重 ICANS(P = 0.251)。严重神经毒性也与严重 CRS 或骨髓疾病无关(P = 0.200 和 0.827)。
到观察终点,4 名患者没有接受任何进一步的治疗,其中 3 名(75%)(7 号、3 号和 1 号)在输注后 1、6 和 7 个月仍处于缓解状态,1 名(6 号)在 6 个月时复发。
3 例(25%)(2、4 和 11 号)患者作为巩固期桥接移植,并在输注 CAR-T 细胞后 7、6 和 10 个月保持缓解。5 例(42%)患者接受序贯 CD22 CAR-T 细胞输注作为巩固治疗,其中 5 例、10 例、12 例在 15、17 和 12 个月时病情缓解,8 例和 9 例在 8 和 3 个月时复发。
3 例复发患者中,CNS 复发 1 例(8 号),CD19 复发 2 例(6 号和 9 号)。中位随访时间为 7 个月(范围 1-17),6 个月 LFS 率为 81.8%(95%CI,59.0-100),1 年总生存率(OS)为 87.5%(95%CI,64.6-100)。
不同巩固疗法分组间 LFS 无显著差异(P = 0.558)。CNS2 和 CNS3 亚组之间的 LFS 没有显著差异(P = 0.155),根据其他临床成因因素,亚组之间的 LFS 没有显著差异。8 例未桥接移植的患者中有 7 例在移植终点没有免疫球蛋白或非恶性 B 细胞恢复。
结论:中枢大负荷的急性 B 淋巴细胞白血病患者接受 CD19 CAR-T 治疗确实可能会发生严重的中枢毒性,所以如果能在回输前把中枢的负荷降下来,可能减低 CD19 CAR-T 细胞治疗的风险。
但对于许多耐药的中枢白血病患者,中枢肿瘤负荷往往降不下来,就需要谨慎选择,同时需要完善的临床处置方案,包括鞘内注射地塞米松可以很好的控制已发生的严重中枢毒性。
本研究所有的中枢大负荷白血病患者都未因出现严重中枢毒性导致死亡和后遗症的情况。值得庆幸的是,中枢白血病患者单纯做 CD19 CAR-T 治疗的预后好于骨髓复发的患者,目前我们团队不建议单纯中枢复发的白血病患者后期接移植或者颅脑放疗,这样患者远期出现严重并发症的可能性大大降低。
本研究原题目:Toxicity and effectiveness of CD19 CAR T therapy in children with high‐burden central nervous system refractory B‐ALL,于 2020.11 公开发表于《Cancer Immunology, Immunotherapy》杂志上。
专家介绍

潘静,副主任医师,高博医学(血液病)研究中心儿童血液病专家,儿童免疫治疗组专家。
中国抗癌协会小儿肿瘤专业委员会专业委员;中国抗癌协会血液肿瘤专业委员会青年委员;中国医药生物技术协会医药生物技术临床应用专业委员会青年委员。
从事儿童血液科临床工作多年,积累了丰富的临床及科研经验。在儿童白血病的化疗,儿童先天性骨髓衰竭综合征和 CAR-T 细胞免疫治疗等方面积累了丰富的临床经验。致力于 CAR-T 治疗的分层治疗,优化 CAR-T 治疗过程中的并发症处理,建立 CAR-T 治疗后的疗效监控体系。
2015 年起,从事 CAR-T 细胞治疗的临床研究工作,目前每年进行 CAR-T 治疗难治复发 B 系淋巴细胞白血病 200 多例,疗效在国际处于先进水平。
相关的 CD19-CAR-T 大规模研究和 CD22-CAR-T 大规模研究, CD19-22 序贯 CAR-T 研究率先发表在国际血液病权威杂志期刊 blood 和 Leukemia 上。并多次在国内外学术会议 (美国血液年会 ASH, 欧洲血液年会 EHA, 日本血液年会 JSH) 汇报团队免疫治疗的最新进展。
*声明:本内容仅代表文章来源方观点,不代表本站立场。本内容仅供医学药学专业人士阅读,不构成实际治疗建议。
好文章,需要你的鼓励
















