近日,南京医科大学第二附属医院顾民教授团队在国际权威期刊《Advanced Science》发表题为「Rictor Ameliorates Acute Antibody-Mediated Rejection Following Kidney Transplantation by Suppressing Macrophage M1 Polarization Through p65-NLRP3 Axis」的研究论文。

该研究发现,巨噬细胞活化在肾移植术后抗体介导排斥反应(ABMR)移植肾局部免疫微环境中发挥重要作用,而 Rictor/mTORC2 信号通路有助于抑制 M1 型巨噬细胞极化,减轻移植肾组织学损伤,延长移植肾存活时间。该研究为肾移植术后 ABMR 的细胞疗法提供了新思路。
顾民教授、沈百欣副主任医师、王子杰副主任医师为该论文的通讯作者,倪斌博士为该论文的第一作者,该研究得到国家自然科学基金资助。
ABMR,肾移植的「隐形杀手」
肾移植作为终末期肾脏病最为有效的治疗方案,能够显著延长患者生存时间,并明显提高生活质量。ABMR 是肾移植术后免疫介导移植肾丢失的主要原因,因其发病机制复杂、治疗手段有限,被称为「隐形杀手」。据统计,ABMR 发病率逐年上升,且早期巨噬细胞浸润与移植肾预后不良密切相关,但具体机制一直未被阐明。
顾民教授团队的新发现
临床标本中发现蛛丝马迹
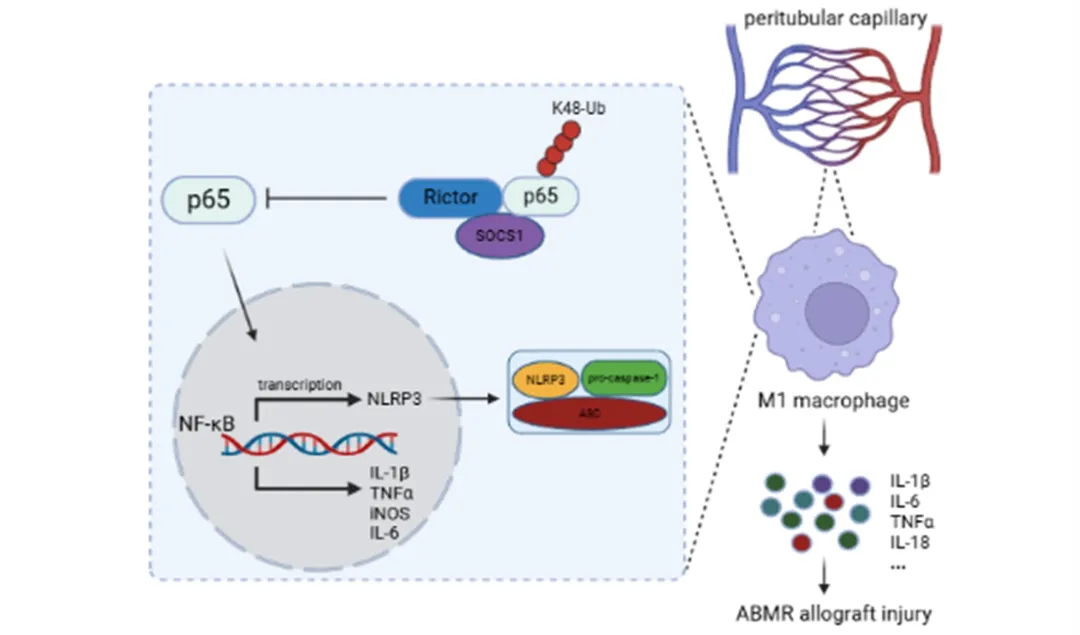
该研究通过分析临床 ABMR 患者的移植肾活检标本,首次发现 M1 型巨噬细胞极化在 ABMR 移植肾组织中显著增加,且与移植肾损伤程度正相关;移植肾中巨噬细胞 Rictor(mTORC2 复合物的关键组分)表达异常上调,可能是调控 ABMR 的关键分子。
改良动物模型,助力 ABMR 研究
该研究创新性地改良了小鼠肾移植术后急性 ABMR 模型,能够更好地模拟人体 ABMR 的病理生理改变。利用 Cre-Loxp 系统构建巨噬细胞 Rictor 特异性缺失的基因敲除鼠,发现 Rictor 缺失会加剧 M1 型巨噬细胞极化,导致移植肾炎症加重、组织学损伤恶化,最终缩短移植肾存活时间。
巨噬细胞活化机制探索
该研究精准分选了移植肾中的巨噬细胞进行高通量测序,发现 Rictor 通过上调 E3 泛素连接酶 SOCS1,促进炎症关键因子 p65 的泛素化降解,进而抑制 NLRP3 炎症小体的激活组装,阻断「炎症风暴」,从而改善 ABMR 预后。
科学意义:ABMR 治疗的新策略
靶向干预:Rictor/mTORC2 信号通路可作为 ABMR 治疗的潜在靶点;
细胞疗法: 通过调控移植肾局部免疫微环境中巨噬细胞活化,或能开发新型免疫调节策略;
临床转化: 未来可研发靶向巨噬细胞 Rictor 的药物,改善移植肾预后。
顾民教授表示,ABMR 作为造成移植肾丢失的最主要原因,对移植肾远期预后产生深远的影响,其发生机制与防治研究仍是目前的热点与难点。此项研究从临床问题出发,结合基础实验,首次明确了巨噬细胞活化在 ABMR 移植肾局部免疫微环境中的重要作用,未来我们将进一步探索靶向 Rictor 调控巨噬细胞活化的药物,为肾移植患者提供更精准的治疗方案。
好文章,需要你的鼓励
















