来源:《临床儿科杂志》
马晨曦, 刘久煜, 朱一辉, 张沛, 高春林, 夏正坤. 儿童共患 ANCA 相关性血管炎肾损害双胞胎一对报告 [J]. 临床儿科杂志, 2025, 43(8): 615-620 DOI:10.12372/jcp.2025. 24e1317
MA Chenxi, LIU Jiuyu, ZHU Yihui, ZHANG Pei, GAO Chunlin, XIA Zhengkun. Two cases of renal damage in twin children with co-morbid ANCA-associated vasculitis[J]. Journal of Clinical Pediatrics, 2025, 43(8): 615-620 DOI:10.12372/jcp.2025.24e1317
本文作者:马晨曦 1 刘久煜 1 朱一辉 1 张 沛 1 高春林 1 夏正坤 1
作者单位:1. 南京医科大学金陵临床医学院儿科(江苏南京 210002);2. 南京信息工程大学(江苏南京 210044)
摘要:儿童期发病的抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAVs)是一组以产生 ANCA 为特征的全身性小血管炎。儿童原发性 AAVs 比较罕见。一般认为,AAVs 的发生与免疫失调、环境及感染等因素相关,其很少在家族中聚集发生。本文报道了一对共患 AAVs 的双胞胎姐妹。姐姐于 9 岁时因「贫血 20 余天,尿检异常 3 天」就诊后,确诊为 ANCA 相关血管炎、ANCA 相关性肾炎。妹妹在姐姐诊断后进行了尿常规筛查,发现也存在血尿和蛋白尿,并进一步确诊。2 例患儿的疾病分型和分级均有所不同,临床表现和经治后的疾病转归也有很大差异。其中,姐姐肾脏病理表现为 ANCA 相关性肾损害合并免疫复合物沉积,表现为较差的肾脏结局;而妹妹经治疗后肾功能已恢复。后续外显子测序未发现与疾病相关变异。
关键词:ANCA 相关性血管炎;ANCA 相关性肾炎;双胞胎
儿童期发病的抗中性粒细胞胞浆抗体(ANCA)相关性血管炎(AAVs)是一组以产生 ANCA 为特征的全身性小血管炎。儿童原发性 AAVs 比较罕见,女性居多,发病高峰年龄在第二个十年。AAV 的发生与免疫失调、环境及感染等因素相关。该病累及肾脏时主要引起寡免疫复合物沉积的肾小球肾炎。东亚人群中 AAV 的流行病学特征与欧洲人群之存在显著差异,这种人口差异表明遗传背景在疾病背后起关键作用。这可能与遗传易感性或共同的环境诱因相关 [1]。本文通过回顾共患 AAV 相关肾炎的一对双胞胎患儿,评估其临床、病理特征及转归,以期为 AAV 相关遗传背景提供依据。
1 病史资料
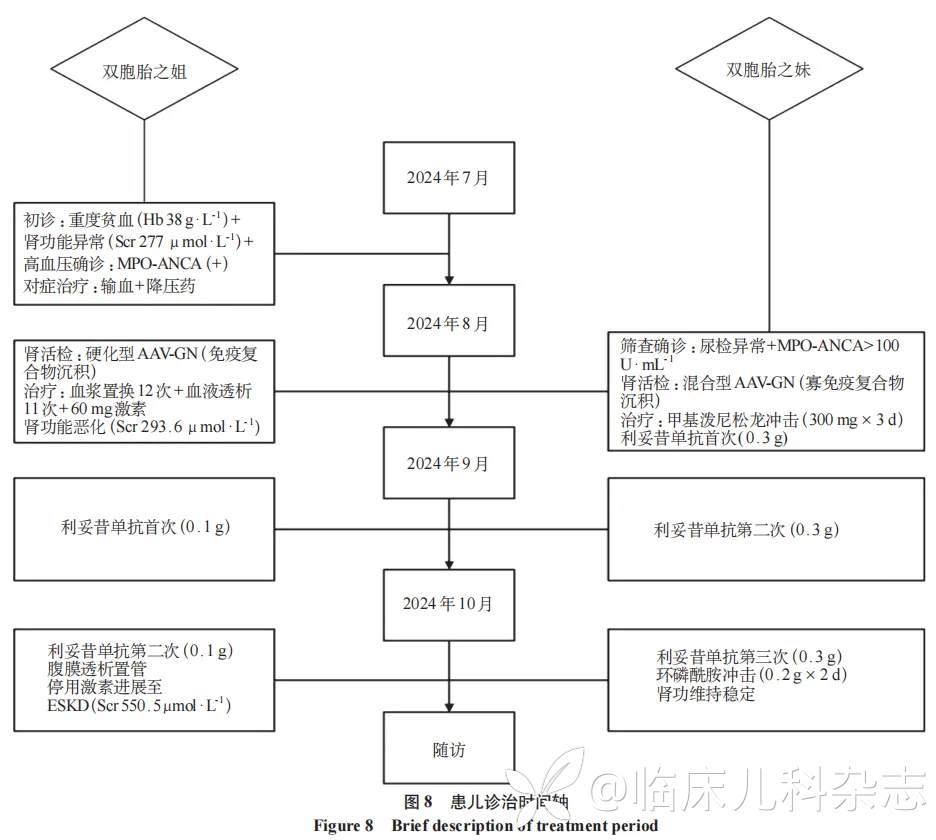
例 1 双胞胎之姐,9 岁,2024 年 7 月患儿因「面色苍白」就诊当地医院,查血红蛋白 52 g/L,红细胞体积 70fL,血小板计数 208×109/L,后复查血红蛋白 38 g/L,甲状旁腺激素(PTH)179pg/mL,尿蛋白+++,肌酐 277μmol/L,P-ANCA(+),MPO-ANCA(+),外院予红细胞 4 个单位输注、人血促红素改善贫血、美托洛尔及氨氯地平控制血压等治疗。G2P2,父母及哥哥体健,否认肾脏病家族史。
查体:体温 36.3℃,脉搏 81 次/min,呼吸 22 次/min,收缩压(SBP)/舒张压(DBP)115/65 mmHg。意识清,精神欠佳,贫血貌。皮肤黏膜色泽苍白,口唇稍苍白,巩膜无黄染。双肺呼吸音低,未闻及啰音。心率 81 次/min,心律齐,无杂音。腹软,无压痛、反跳痛及肌紧张,肝脾不大。双侧下肢未见皮疹及出血点,无凹性水肿。
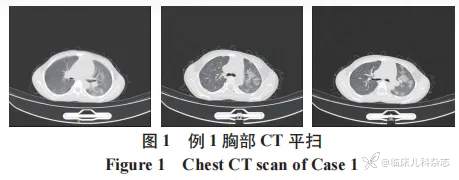
实验室检查 :尿蛋白 ++~+++,尿红细胞计数 236.70/μL,混合型红细胞,尿蛋白定量 1.40 g/24 h,血红蛋白 102 g/L,血小板计数 281×109/L,C 反应蛋白 0.9 mg/L,纤维蛋白原 4.09 g/L, 纤维蛋白 (原) 降解产物 16.20 μg/mL,D-二聚体 6.11 mg/L,甲状旁腺激素 118.20 pg/mL,总 25 羟维生素 D 14.13ng/mL,血清白蛋白 28.80 g/L,血肌酐 293.60μmol/L,胱抑素 C3.48 mg/L,抗肺炎支原体 IGM 抗体(±),pANCA(+),MPO-ANCA>100.00U/mL,抗肾小球基底膜 (GBM) 抗体定量<2 AU/mL,余自身抗体阴性,传染病检测阴性。完善胸部 CT(图 1)提示 :两肺炎症,左肺为著。
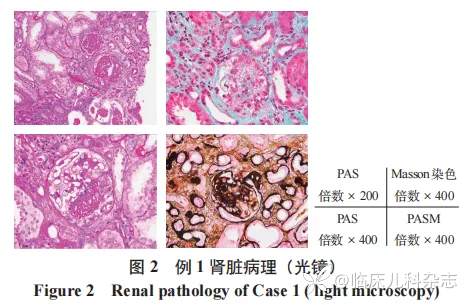
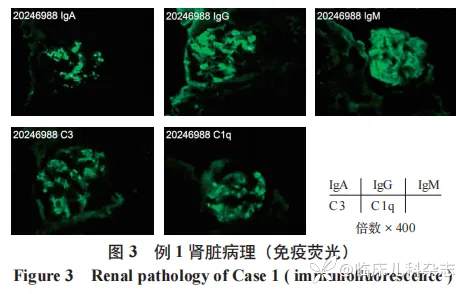
肾脏病理见图 2、图 3,光镜 :皮髓质肾组织 1 条、髓质肾组织 1 条。8 个肾小球中 5 个球性废弃,3 个节段硬化。余肾小球系膜区轻度增宽,系细胞增生,基质增多,多数球毛细血管袢开放好,节段外周袢与囊壁粘连,囊壁节段增厚分层。PASM-Masson:肾小球系膜区偶见嗜复红物沉积。肾小管间质中度慢性病变,多处灶性小管萎缩、基膜增厚,未萎缩肾小管肥大、扩张,散在肾小管上皮细胞刷状缘脱落,管腔内见少量蛋白管型,间质纤维化 ++,较多单个核细胞浸润,散在中性粒胞。少数小动脉管腔闭锁。免疫荧光;肾小球,冰冻切片荧光染色示肾小球 8 个,其中 6 个硬化球。lgG++颗粒状沉积于系膜区,呈球性分布。lgA++,颗粒状沉积于系膜区,呈球性分布。IgM+,颗粒状沉积于系膜区,呈球性分布。C3+,颗粒状沉积于系膜区,呈球性分布。C1q+,颗粒状沉积于系膜区,呈球性分布。Fibrin 阴性。肾小管,小管基膜未见免疫球蛋白、补体沉积。血管壁,间质血管未见免疫球蛋白、补体沉积。IV 型胶原,未见明显异常。电镜:见 1 个硬化球,间质见炎细胞浸润。
诊治经过:入院后即刻留取血样,完善相关检查。治疗上予泼尼松 60 mg/d 免疫抑制治疗、多糖铁复合物胶囊补铁,苯磺酸氨氯地平、琥珀酸美托洛尔控制血压,头孢哌酮舒巴坦及阿奇霉素抗感染治疗。入院后 14 天完善肾活检,结合临床明确诊断为 ANCA 相关性血管炎、ANCA 相关性肾炎、慢性肾脏病 4 期、肾性贫血、继发性甲状旁腺功能亢进、肺炎。间断行血浆置换术 12 次清除抗体,间断予人促红素、罗沙司他改善贫血。病程中患儿出现尿量减少、腹部渐膨隆,胸部 CT 提示肺部炎症未吸收,予左氧氟沙星、美罗培南、利奈唑胺抗感染治疗,并间断行 11 次血液透析治疗。患儿病程中出现免疫功能降低,白细胞计数最低至 2.1×109/L,CD4+细胞计数最低至 35 个/μL,间断予人粒细胞刺激因子、胸腺法新提高免疫功能,复方磺胺甲噁唑预防肺孢子菌感染;激素规律减量,入院后第 61 天、71 天予利妥昔单抗 0.1 g 靶向治疗 2 次,过程顺利;79 天行腹膜透析导管置入术,患儿腹膜透析术后恢复良好,现持续腹膜透析治疗中。入院后第 76 天激素减停。
例 2 双胞胎之妹,9 岁,患儿因其姐发现血肌酐升高、贫血及尿检异常就诊我院,查尿蛋白+++,隐血+++。G2P2,父母及哥哥体健,姐患 ANCA 相关性肾炎。
入院后查体:体温 36.3℃,脉搏 80 次/分,呼吸 22 次/分,SBP/DBP105/75 mmHg。意识清,精神可,贫血貌。皮肤黏膜色泽正常,巩膜无黄染,心肺听诊无异常。
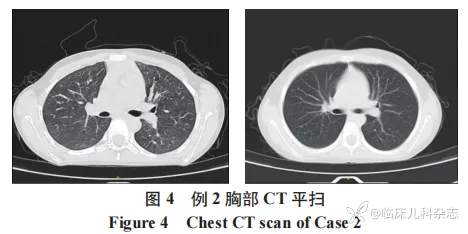
实验室检查 :血红蛋白 125 g/L,血小板计数 174×109/L,C 反应蛋白<0.5 mg/L,尿蛋白++,红细胞计数 22.80/μL,非均一性红细胞,尿蛋白定量 0.59 g/24 h,甲状旁腺激素 (PTH) 25.83 pg/mL,总 25 羟维生素 D 24.86ng/mL,肌酐 32.60μmol/L,抗肺炎支原体 IGM 抗体 (A-MP) 阳性(+)。P-ANCA(+),MPO-ANCA>100.00 U/mL,抗肾小球基底膜 (GBM) 抗体定量<2 AU/mL。余自身抗体阴性,传染病检测阴性。胸部 CT(图 4) 示两肺散在良性小结节。
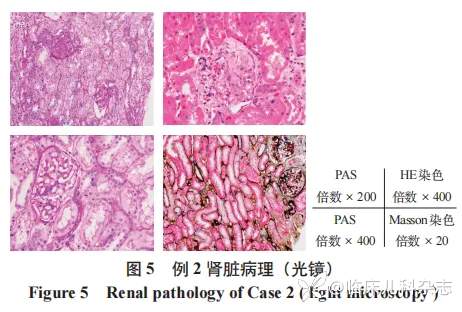
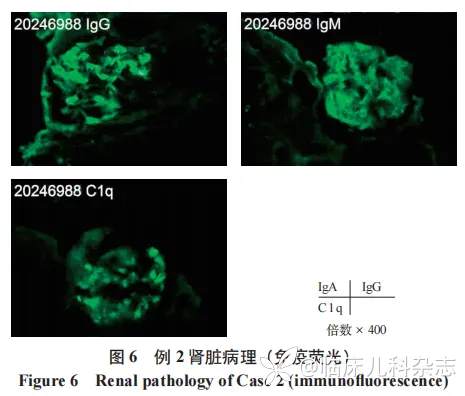
肾脏病理见图 5、图 6,光镜:皮质肾组织 1 条、髓质肾组织 1 条,17 个肾小球中 3 个球性废弃,5 个节段硬化/瘢痕,个别硬化处见新月体残迹 ;余肾小球节段系膜区轻度增宽,多数球毛细血管袢开放好,节段外周袢与囊壁粘连,囊壁节段增厚分层。PASM-Masson:肾小球未见明确嗜复红物沉积。肾小管间质轻度慢性病变,小灶性肾小管萎缩、基膜增厚,间质纤维化+,少量单个核细胞浸润。动脉未见明确病变。免疫荧光 ;肾小球,冰冻切片荧光染色示肾小球 2 个,其中 1 个硬化球。IgAtrace,颗粒状沉积于系膜区,呈球性分布。IgG 阴性、C3 阴性、Fibrin 阴性。肾小管,小管基膜未见免疫球蛋白、补体沉积。血管壁,间质血管未见免疫球蛋白、补体沉积,动脉未见明确病变。电镜 :肾小球节段系膜区增宽,系膜细胞和基质增多,系膜区未见电子致密物沉积。
诊治经过:入院后完善相关检查,予泼尼松 60 mg/d 免疫抑制治疗,入院后第 11 天至第 13 天予患儿甲基泼尼松龙 300 mg×3d 冲击治疗,第 20、51、70 天分别予利妥昔单抗 0.3 g 靶向治疗,第 92、93 天予环磷酰胺 0.2 g×2d 冲击治疗。患儿病程中及随访肾功能正常,第 69、91 天复查 MPO-ANCA 滴度分别为 297.4AU/mL、>300 AU/mL。后续完善全外显子组基因检测,未发现与疾病表型相关的明确致病性变异。
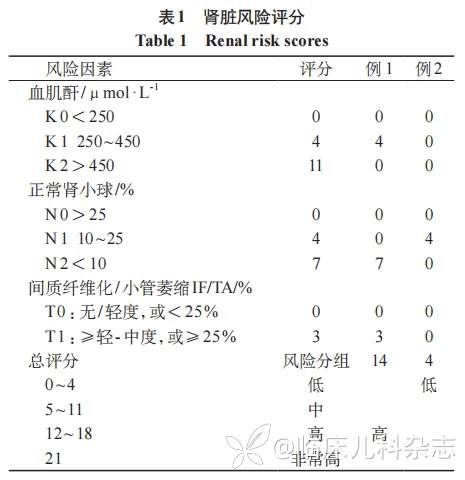
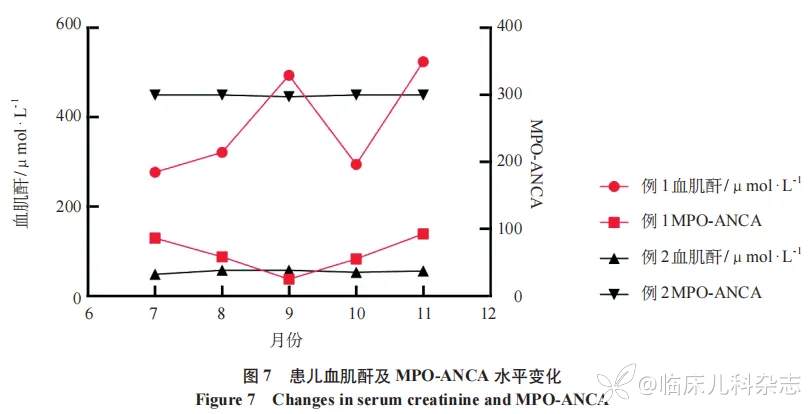
对两位患儿进行肾脏病理分型及风险度评分,参考 Berden 分型例 1 为硬化型 AAV-GN,例 2 为混合型 AAV-GN。依据 Bate 等 [2] 改良的 ANCA 肾脏风险评分进行评估,结果见表 1。患儿血肌酐及 MPO-ANCA 变化见图 7。患儿诊治时间轴见图 8。
2 讨论
抗中性粒细胞胞浆抗体相关血管炎(AAV)是一种以中小血管为主要受累对象的系统性自身免疫病。其病理特征表现为全身多器官系统损伤,核心发病机制涉及 ANCA 介导的免疫反应和 T 淋巴细胞功能失调。AAV 家族聚集报道罕见 [3-4],已经观察到 AAV 与人类白细胞抗原(HLA)区域之间的显著相关性,且 AAV 亚型与不同的 HLA 变异相关:GPA 和 PR3-ANCA 与 HLA-DP1 相关,MPA 和 MPO-ANCA 与 HLA-DQ 相关。本案例双胞胎共患 MPO-ANCA 阳性 AAV,高度提示潜在的遗传易感性。然而,全面的外显子组测序未能鉴定出明确的致病性变异,这与当前对 AAV 复杂遗传架构的认识相符——其更可能涉及多基因效应及基因-环境交互作用,而非单基因遗传。针对此类家族聚集病例,进行更深入的基因组学研究和环境暴露史调查十分重要。
儿童 AAV 相关肾小球肾炎(AAGN)肾脏预后差,20%~35% 患儿会发展为 ESKD。Berden 分型(局灶型、新月体型、混合型、硬化型)是重要的病理预后指标,其中硬化型预后最差,而在此分类中未涉及的 ANCA 血清型、IF/TA 及肾功能等参数随后也被证明具有预后价值。2018 年提出的 ANCA 肾脏风险评分 (ARRS) 整合了估算肾小球滤过率 (eGFR)、正常肾小球比例和肾间质纤维化/小管萎缩 (IF/TA) 程度,可有效预测成人 AAGN 患者的 ESKD 风险,并被证实在儿童群里中也是 ESKD 的独立预测因子 [5]。2023 年 Bate 等 [2] 提出了改良的 ARRS,该评分中使用血肌酐值取代了 eGFR,更新了对正常肾小球、IFTA 的评分,并将风险分层扩展为低、中、高、极高四组,3 年肾脏存活率分别为 96%、79%、54% 和 19%。本研究中,应用改良 ARRS 准确评估了姐妹两人肾脏风险(例 1 高风险 14 分,例 2 低风险 4 分),与最终临床结局高度一致。尽管改良 ARRS 在儿童中的预测效能仍需更大样本验证,本研究支持其在儿童 AAGN 风险分层和个体化管理中的潜在价值。
典型的 AAGN 表现为寡免疫复合物沉积。然而,例 1 肾脏免疫荧光显示显著的系膜区 IgG、IgA、IgM、C3、C1q 沉积,这种伴免疫复合物沉积的 AAV 的临床意义存在争议。华胄等研究认为伴 IgA 沉积的 AAV 患者与寡免疫复合物沉积 AAV 患者临床表现与预后无显著差异 [6]。但也有研究显示,MPO-ANCA 相关性肾小球肾炎患者肾小球免疫沉积与较差的肾脏预后有关 [7]。动物模型提示包括 IgA 在内的免疫复合物在 AAV 疾病的早期阶段出现,后期消退 [8]。也有报道显示,经过免疫抑制剂治疗后的伴 ANCA 阳性的 IgAN 患者 IgA 沉积持续存在 [9]。本案例中,例 1 显著的免疫复合物沉积与其快速进展至 ESKD 的不良预后相符,而例 2 仅微量 IgA 沉积且预后良好。这种差异可能部分解释了临床表现的异质性。补体系统在 AAV 发病机制中的作用日益受到重视 [10-11],Yu 等 [12] 报道伴免疫复合物(IC)沉积的 AAGN 患者补体下降的发生率更高。例 1 病程中 C3 最低降至 0.751 g/L,提示补体活化可能参与其发病过程。此外,AAV 合并其他类型肾小球疾病(如 IgA 肾病)也有报道 [13-14],其发病机制可能涉及不同病理过程的叠加或先后发生。患儿肾脏病理及补体系统表现差异一定程度可解释两者临床表现的异质性。此外,ANCA 滴度升高通常被认为与疾病活动性及复发相关,但在本病例系列研究中,我们观察到维持临床缓解的患儿存在 ANCA 水平持续高值的情况 [15]。这提示在 ANCA 滴度与疾病活动状态之间的关系可能更为复杂,需进一步研究阐明。ANCA 滴度的变化需要与临床评估相结合,以便为后续诊治提供依据。
本研究首次报道了一对双胞胎姐妹共患 AAV 相关肾损害的罕见案例,两例患儿为双胞胎且共患同一疾病,但表现出显著的临床、病理及预后异质性。改良 ARRS 在本案例中展现出良好的风险预测价值。免疫复合物沉积及补体激活可能介导部分 AAGN 患者的严重肾脏损伤,这一机制为补体靶向治疗提供了理论依据。尽管基因检测未发现明确致病变异,该家族聚集病例强烈提示遗传易感性的存在,值得进行更深入的遗传学研究。本案例强调了在 AAV 患儿亲属中进行早期筛查的重要性,并提示免疫复合物沉积可能是预后不良的标志之一。
好文章,需要你的鼓励
















