来源:派来帮您
我国肝癌现状
我国是全球肝癌负担最重的国家,每年新发病例和死亡病例均占全球近一半。2022 年数据显示,肝癌发病率位居我国恶性肿瘤第四位,死亡率仅次于肺癌,位列第二。
一个严峻的现实是:我国肝癌患者确诊时肿瘤平均直径达 6.7 厘米,而美国仅为 2.3 厘米—这一差距背后,是早筛早诊体系的薄弱,导致多数患者确诊时已错过最佳治疗窗口。
从病因看,乙肝病毒(HBV)感染是我国肝癌的「头号推手」——92% 的肝癌与 HBV 相关。这意味着,针对 HBsAg 阳性人群的早期筛查与干预,是防控肝癌的核心环节。
肝癌的发生是内外因交织的结果:除了病毒因素以外,长期负面情绪可能抑制免疫系统,遗传易感性则让部分人更易「中招」——例如 65 岁以上人群癌症发生率为 8%,百岁以上人群升至 32%;同卵双胞胎中一人患癌,另一人风险显著升高,均印证了年龄、遗传与肝癌的关联。
家族史推着慢乙肝患者走向肝癌
肝癌并非严格意义上的遗传病,但肝癌家族史却如同肝癌的「隐性推手」。我国《慢性乙型肝炎防治指南(2022 版)》明确指出,年龄>40 岁、男性、合并肝硬化、有肝癌家族史或 HBV 病毒高载量的慢乙肝患者,均属肝癌高危人群。
Meta 分析显示,有家族史的慢乙肝患者肝癌发生风险是无家族史者的 3.58 倍,是普通人群的 30 倍左右。根据肝癌发生风险分层,慢乙肝患者只要存在肝癌家族史,就可能成为肝癌高危或极高危人群。
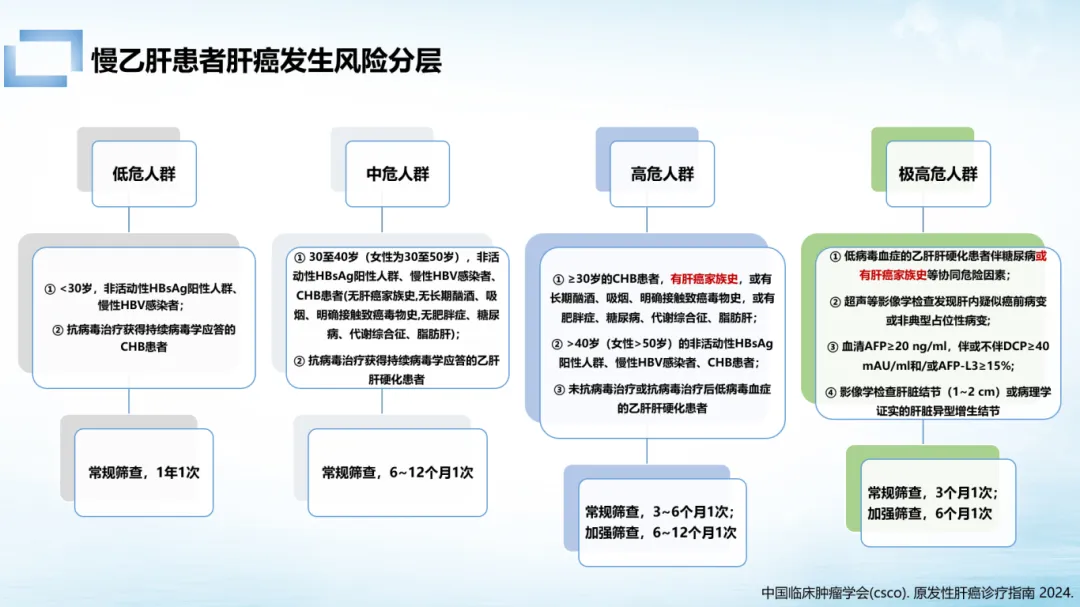
肝癌的家族聚集性还表现为发病年龄逐代提前—有家族史者往往比散发患者更早罹患肝癌,且随遗传代数传递,年轻化趋势明显。
这种家族聚集现象的背后,有三重致命机制:
01 病毒「同源」陷阱:家族内 HBV 感染常为同一病毒株,相似的病毒基因型可能导致更一致的肝损伤路径;
02 长期感染的累加效应:家族内感染者病程更长,更易出现反复炎症,且病毒 DNA 更易整合到肝细胞基因组,诱发基因突变
03 遗传易感性的内在驱动:特定基因突变(如抑癌基因异常)或表观遗传改变可能在家族中传递,使肝细胞对病毒致癌作用更敏感。
如何降低肝癌风险?
对于慢乙肝合并肝癌家族史的人群,抗病毒治疗是降低肝癌风险的核心手段。指南明确建议:只要 HBV DNA 阳性且有乙肝肝硬化或肝癌家族史,无论肝功能指标(ALT)是否正常,均建议进行治疗。数据显示,接受抗病毒治疗可以降低慢乙肝患者 40%-60% 的肝癌发病风险。
现有大量数据显示,核苷(酸)类似物(NAs)单药治疗可使肝癌风险降低 50%,但 5 年累积发生率仍约 7% 左右,未能实现 HBV DNA 转阴(如低病毒血症)的患者,肝癌风险更高(18.8%),这提示我们提示单纯抑制病毒复制尚不足够。
聚乙二醇干扰素α(PEG IFNα、长效干扰素)的应用带来突破。
中国台湾研究显示,长效干扰素治疗可使肝癌风险降低 90%;瑞金医院研究证实,无论整体人群还是肝癌高危人群,基于 PEG IFNα的治疗在降低肝癌风险上均显著优于 NAs。越来越多的研究显示,PEG IFNα治疗可以极大降低慢乙肝患者肝癌风险,5 年内肝癌风险低于 1%。
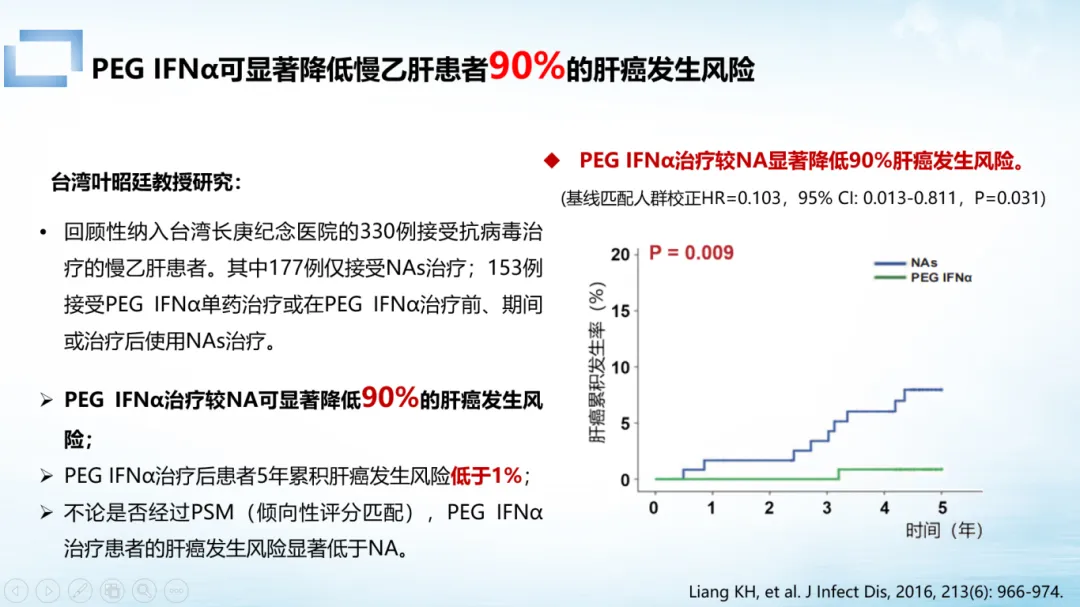
这种差异源于作用机制的不同:NAs 仅抑制病毒的复制,而 PEG IFNα不仅激活肝细胞抗病毒蛋白,更能通过上调免疫细胞功能重建免疫监视—这种「抗病毒+免疫调节」的双重机制,使其在肝癌预防中更具优势。临床中,NAs 与 PEG IFNα联合可发挥协同效应:前者快速降病毒,后者通过激活身体免疫,实现肝癌风险最大化控制 [1]。
走出「家族史 = 宿命」的误区
需要明确的是,肝癌并非遗传性疾病,但其家族聚集性提示特定人群需更积极的健康管理。遗传易感性只是增加了患病「可能性」,而非「必然性」。
对有肝癌家族史的慢乙肝患者而言,家族史不是「枷锁」,而是早期干预的「信号灯」。随着医学进步,从单纯抑制病毒到抗病毒+激活免疫的治疗升级,正让更多慢乙肝肝癌高危人群远离肝癌。
肝癌防控的战场,不在确诊之后,而在更早的关口。对高危人群而言,重视家族史传递的风险信号,主动拥抱科学复查与规范治疗,就能让自己与癌变之间筑起一道关键防线,守护自己与家族的肝脏健康。
图片来源:讲者幻灯
参考文献:
[1] 李明慧. 肝癌家族史慢乙肝人群肝癌发生风险及治疗. 第十三届全国疑难及重症肝病大会
好文章,需要你的鼓励
















