来源:《临床儿科杂志》
高晓岚, 梁欢, 陈国庆, 张惠文, 韩连书, 邱文娟, 顾学范. 滤纸片干血斑酶活性检测用于新生儿黏多糖贮积症Ⅱ型筛查的初步研究 [J]. 临床儿科杂志, 2025, 43(3): 191-198 DOI:10.12372/jcp.2025.24e0514
GAO Xiaolan, LIANG Huan, CHEN Guoqing, ZHANG Huiwen, HAN Lianshu, QIU Wenjuan, GU Xuefan. Exploring the feasibility of enzyme activity assay of dried blood spots for newborn screening of mucopolysaccharidosis type Ⅱ[J]. Journal of Clinical Pediatrics, 2025, 43(3): 191-198 DOI:10.12372/jcp. 2025.24e0514
本文作者:高晓岚 梁 欢 陈国庆 张惠文 韩连书 邱文娟 顾学范
作者单位:上海交通大学医学院附属新华医院 上海市儿科医学研究所 儿内分泌遗传科(上海 200092)
摘要:目的 探索滤纸片干血斑(DBS)检测艾杜糖醛酸-2-硫酸酯酶(IDS)活性用于筛查新生儿黏多糖贮积症Ⅱ型(MPS Ⅱ)的可行性。方法 采用荧光定量法检测 DBS 的 IDS 活性,对医院新生儿疾病筛查中心 2021 年 2 月至 4 月出生的 2202 例男性新生儿进行 MPS Ⅱ筛查。将 2012 年 3 月至 2020 年 12 月儿内分泌遗传科收集的已确诊的 51 例 MPS Ⅱ患儿、15 例 MPS Ⅱ女性携带者及 32 例非 MPS Ⅱ患儿(对照组,均为男性)作为试筛人群。初步拟定筛查阳性切值,阳性者召回后复查酶活性,并进行尿液黏多糖和 IDS 基因检测。结果 51 例 MPS Ⅱ患儿中位年龄 4.2 岁,15 例 MPSⅡ女性携带者中位年龄 27.5 岁,32 例对照组中位年龄 4.5 岁,绘制 ROC 曲线在 98 例试筛人群中获得 DBS 法检测血 IDS 活性的最佳阈值为 9. 59ρmol/(punch·20 h),灵敏度为 100%,特异度为 22.7%,AUC 为 0.962(0.928~0.995);并进行白细胞法与 DBS 法的一致性检验分析,Kappa= 0.96(P<0.001)。以 DBS 法检测 2202 名新生儿 IDS 活性水平,中位数为 58.22ρmol/(punch·20 h),中位数的 20% 为 11.64ρmol/(punch·20 h)。无论以 DBS IDS 活性 ≤ 9.59ρmol/(punch·20 h),还是 ≤ 11.64ρmol/(punch·20 h) 作为阳性切值,均为 6 例(0.27%)阳性。6 例阳性患儿全部召回,筛查阳性者中,虽有 3 例尿黏多糖检测定性阳性,但电泳仅显示硫酸软骨素区带,未见硫酸皮肤素及硫酸类肝素区带;基因检测发现 5 例携带母亲来源的 IDS 错义突变 c.851C>T(p.P284L),另有 1 例携带 c.1499C>T(p.T500I) 错义突变,均被归为良性变异。结论 DBS IDS 活性检测能够有效地快速识别出 MPS Ⅱ可疑患儿,可尝试用于新生儿 MPS Ⅱ的筛查,但仍需大样本量研究确定准确的阳性切值。
关键词:黏多糖贮积症Ⅱ型;艾杜糖醛酸-2-硫酸酯酶;滤纸片干血斑;新生儿筛查
黏多糖贮积症Ⅱ型(mucopolysaccharidosis type Ⅱ,MPS Ⅱ)为 X 连锁隐性遗传的溶酶体贮积症,又被称为 Hunter 综合征,由于艾杜糖醛酸-2-硫酸酯酶(iduronate-2-sulfatase,IDS)基因变异引起 IDS 活性缺乏,导致糖胺聚糖(glycosaminoglycans,GAGs),包括硫酸皮肤素(dermatansulphate,DS)和硫酸类肝素(heparansulphate,HS)不能被完全降解,从而贮积在全身各组织、器官的溶酶体中 [1]。临床表现为生长发育迟缓、智力低下、特殊面容、肝脾肿大、气道狭窄和心脏瓣膜疾病等,中位死亡年龄不足 15 岁 [2]。
MPS Ⅱ在男性中发病率约为 1/(70000 ~170000)[3-4]。尽管 MPS Ⅱ发病率较低,但该病患儿严重的脑功能倒退会给家庭、社会带来沉重的医疗负担,并且 MPS Ⅱ患儿表型异质性强,部分患儿在早期不易识别,随着国家生育政策的开放,在同一个家庭中可能出现多个病例,危害性较大。因此,MPS Ⅱ的新生儿筛查具有重要的社会价值。目前,美国、日本和中国台湾等地区,已将 MPS Ⅱ纳入推荐的新生儿筛查 [5]。滤纸片干血斑(dried blood spot,DBS)是将血滴在专用卡纸上,干燥后形成的血斑点,可用于微量血液样本的储存、运输和分析检测。与传统的血液检查方式相比,DBS 具有独特的优势:采集方便,微量采样,固态血液样品安全、稳定,运输和储存方便,适用于更大规模、更大覆盖面的筛查。我国的 MPS Ⅰ已有商品试剂盒用于筛查,但 MPS Ⅱ还没有商品化试剂盒,因 MPS Ⅱ危害性极大,目前已有干细胞移植及酶替代疗法,且早发现、早诊断及早治疗有助于改善患儿的临床症状,特别是神经系统症状及预后。因此,本研究检测了 2202 例中国男性新生儿 DBS 的 IDS 活性,拟初步探究该方法用于我国 MPS Ⅱ新生儿筛查的可行性。
1 材料与方法
1.1 材料
采用整群抽样法随机抽取 2021 年 2 至 4 月上海交通大学医学院附属新华医院新生儿疾病筛查中心 2202 例男性新生儿筛查用 DBS 标本。
将 2012 年 3 月至 2020 年 12 月本科室收集的已确诊的 51 例 MPS Ⅱ患儿、15 例 MPS Ⅱ女性携带者及 32 例非 MPS 男性患儿(对照组)作为试筛人群。
1.2 方法
1.2.1 滤纸片干血斑艾杜糖醛酸-2-硫酸酯酶活性检测 采用荧光法检测 DBS IDS 活性进行新生儿 MPS Ⅱ筛查,方法参照文献 [6-7]。用荧光底物 4-甲基伞型酮-α艾杜糖-2-硫酸(4MU-IDUS)来测量 DBS 中 IDS 活性。采用干血斑打孔仪取直径为 3.2 mm 的干血斑置于 96 孔板内,每孔加入 40μL 底物溶液及 20μL 人重组艾杜糖苷酶(Sigma,I6034-10UG),37℃ 孵育 20 h,冰上静置 10 min 后离心(4℃、1500×g、5 min)。取 60μL 上清,加入 0.5mol/L 碳酸氢钠-碳酸钠缓冲液(0.25%Triton X-100),H 值 10.7,200μL 终止反应,荧光免疫分析仪在激发波长 355nm 和发射波长 460nm 的条件下检测荧光强度。IDS 活性计算公式:IDS 活性 [ρmol/(punch·20 h)]= 4MU 荧光标准曲线斜率值×(待测样本荧光值-空白荧光值)×反应终体积/punch×反应时间。筛查阳性定义为 IDS 活性浮动切值低于中位数的 20%[7]。对于初筛阳性者,进行原血片的复查,仍为阳性者召回进行确诊性检测,包括基因检测和尿液黏多糖定量、定性(醋酸纤维薄膜电泳法),IDS 白细胞法活性检测。
1.2.2 艾杜糖醛酸-2-硫酸酯酶白细胞法活性检测 用荧光底物 4MU-IDUS 来测量外周血白细胞中 IDS 活性,方法参照文献 [8-9],正常值范围为 16.5~83.0nmol/(mg 蛋白·4 h)。
1.2.3 滤纸片干血斑检测艾杜糖醛酸-2-硫酸酯酶活性精密度实验 取正常人血斑 5 个,连续 8 天进行 IDS 活性测定,计算批内和批间变异系数。
1.2.4 黏多糖贮积症Ⅱ型基因分析 对 IDS 活性筛查疑似阳性的原 DBS 标本抽提 DNA 进行 MPS Ⅱ基因高通量测序判断是否为 MPS Ⅱ患儿。PCR 产物由北京迈基诺医学检验所进行 DNA 测序,DBS 标本提取基因组方法参照 Ruiz-Schultz 等 [10-11] 的报道,对 MPS Ⅱ基因的检测采用 GenCap®溶酶体病基因捕获探针 V2.0,该方法适用于所送检基因的外显子区及与外显子相邻 20bp 的内含子区中的点突变。测序结果根据美国医学遗传学与基因组学学会(ACMG)发布的变异解读指南进行致病性分析,并用人类基因 MPS Ⅱ(OMIM#309900)序列进行比较。
1.3 统计学分析
采用 SPSS 统计软件 20.0 进行数据分析。非正态分布计量资料以 M(P25~P75)表示,组间比较采用 Kruskal Wallis H 检验。计数资料以例数(百分比)表示。采用 Spearman 秩相关分析两变量间相关性。计算 Kappa 系数评估白细胞法与 DBS 法检测 IDS 活性的一致性。采用 ROC 曲线确定试筛人群 DBS 法测得的 IDS 酶活性的最佳阈值。以 P<0.05 为差异有统计学意义。
2 结果
2.1 滤纸片干血斑检测 MPS Ⅱ女性携带者、患儿及对照组的艾杜糖醛酸-2-硫酸酯酶活性比较
51 例 MPS Ⅱ男性患儿的中位年龄为 4.2(3.3~5.1)岁,15 例女性携带者的中位年龄为 27.5(24.75~32.5)岁,32 例对照组患儿中位年龄 4.5(3.5~5.5)岁。51 例 MPS Ⅱ患儿、15 例女性 MPS Ⅱ携带者及 32 例对照组患儿之间采用 DBS 法测得的 IDS 酶活性差异有统计学意义(P< 0.001),两两比较发现对照组显著高于女性携带者和 MPS Ⅱ患儿,且女性携带者高于 MPS Ⅱ患儿,差异有统计学意义(P<0.05)。见表 1。

2.2 白细胞法与滤纸片干血斑检测艾杜糖醛酸-2-硫酸酯酶活性一致性检验
51 例 MPS Ⅱ患儿白细胞法检测的血 IDS 活性水平为 0.2(0~0.3)nmol/(mg 蛋白·4 h),DBS 法检测的血 IDS 活性水平为 2.2(1.5~3.0)ρmol/(punch·20 h),两者呈显著正相关(rs= 0.71,P<0.001)。
将 51 例 MPS Ⅱ患儿、15 例 MPS Ⅱ女性携带者及 32 例对照组共 98 例作为试筛人群,绘制 ROC 曲线得出 DBS 法检测的血 IDS 活性最佳阈值为 9.59ρmol/(punch·20 h),灵敏度为 100%,特异度为 22.7%,AUC 为 0.962(0.928~0.995)。见图 1。
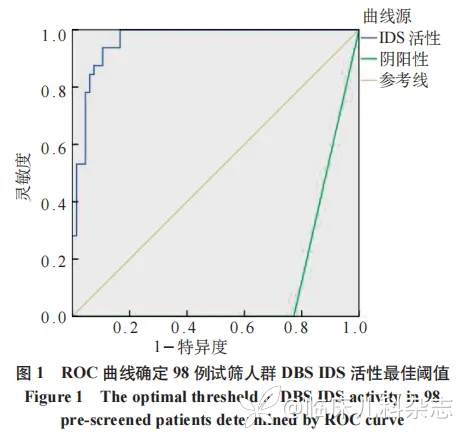
以 DBS IDS 活性 ≤ 9.59ρmol/(punch·20 h)作为阳性切值,对 51 例 MPS Ⅱ患儿、15 例女性 MPS Ⅱ携带者及 32 例对照组患儿进行白细胞法与 DBS 法的一致性检验分析,Kappa= 0.96(P<0.001),提示两种方法对 IDS 的检测有很好的一致性,见表 2。

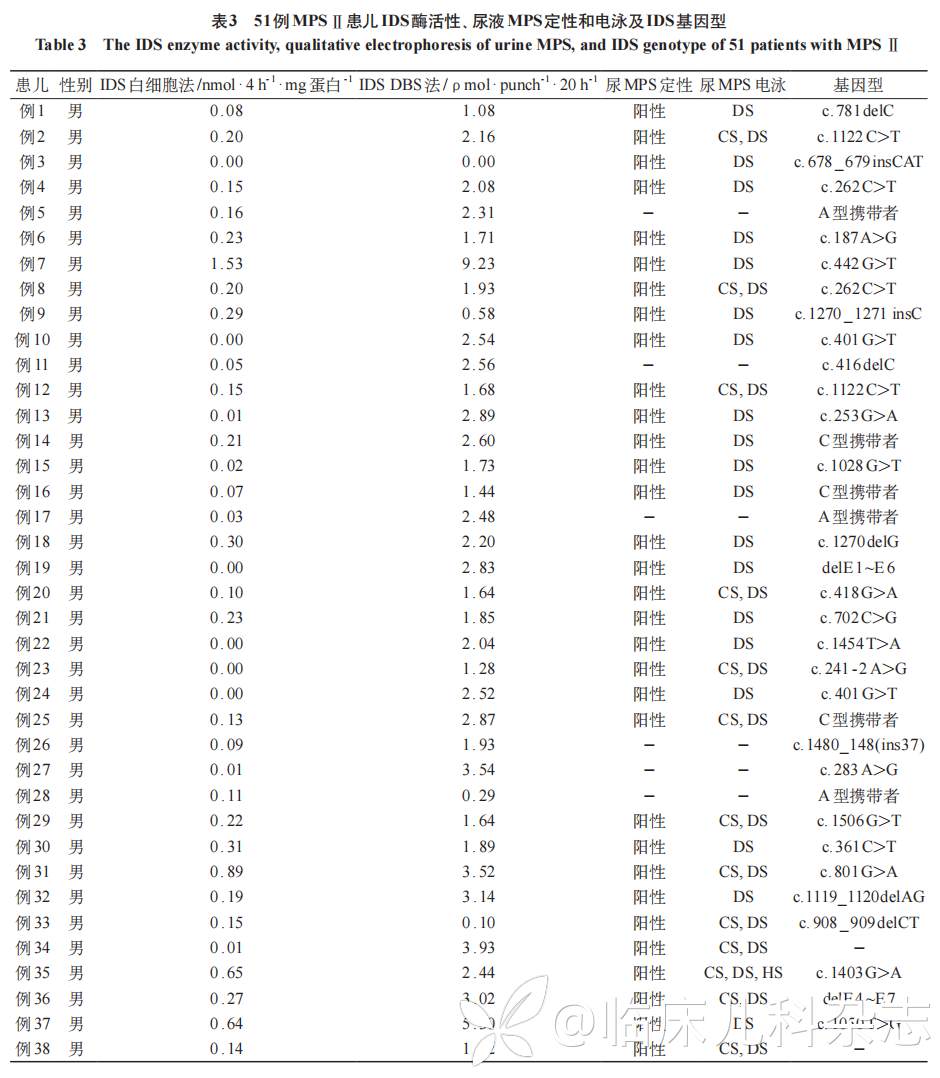
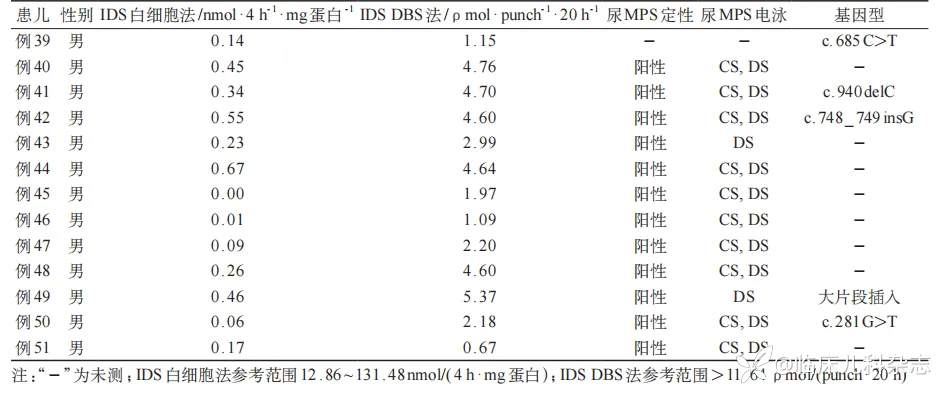
51 例 MPS Ⅱ患儿 IDS 活性、尿液黏多糖定性、电泳及 IDS 基因结果见表 3。患儿的 IDS 活性均低于参考值范围,尿液黏多糖定性阳性,尿黏多糖电泳均有 DS 区带,其中 29 例 MPS Ⅱ患儿 IDS 基因突变位点来自其母亲。
2.3 滤纸片干血斑测定新生儿艾杜糖醛酸-2-硫酸酯酶活性结果及阳性切值确定
DBS 法测得的正常人群 IDS 活性批内变异系数为 5.76%~8.43%、批间变异系数为 7.73%~10.70%,提示该方法精密度较好,可用于 MPS Ⅱ患儿 IDS 活性的新生儿筛查。
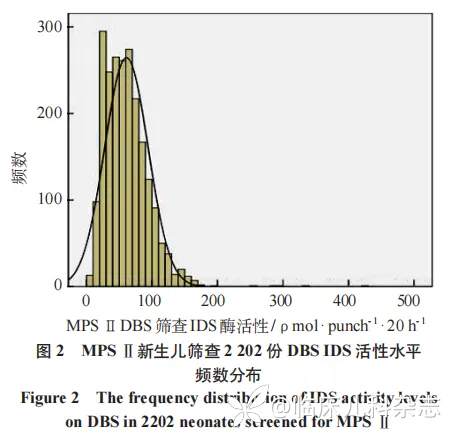
MPS Ⅱ新生儿筛查 2202 份 DBS IDS 活性水平频数分布见图 2。对其正态性检验显示偏度值为 1.80,峰度值为 10.84,提示该组数据为曲线较陡峭的正偏态分布,中位数为 58.22(23.29~ 93.15)ρmol/(punch·20 h),参照文献 [7],即筛查阳性定义为 IDS 活性浮动切值 ≤ 中位数的 20%,则阳性切值为 11.64ρmol/(punch·20 h),在 98 例试筛人群中进行白细胞法与 DBS 法的一致性检验分析,Kappa= 0.98(P<0.001)。
2.4 滤纸片干血斑筛查阳性新生儿的确诊性检测结果分析
在 2202 例新生儿筛查样本中,以 DBS IDS 活性 ≤ 9.59ρmol/(punch·20 h) 作为阳性切值,初筛阳性 11 例,共 6 例(0.27%)复查阳性。以 DBS IDS 活性 ≤ 11.64ρmol/(punch·20 h)作为阳性切值,初筛阳性 17 例,共 6 例(0.27%)复查阳性。
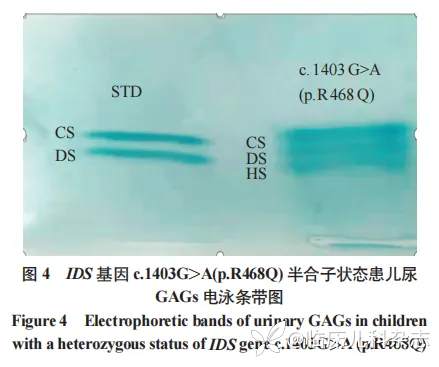
6 例阳性患儿全部召回,其中 3 例进行了尿液黏多糖的定量和定性检测,均存在尿液黏多糖定量水平偏高,见表 4。但尿液黏多糖电泳仅有 CS 条带,未见 DS 和 HS 条带,见图 3。图 4 为尿液 GAGs 阳性对照图,IDS 基因 c.1403 G>A(p.R468Q)半合子状态的患儿,其尿 GAGs 电泳可见 DS 和 HS 条带。
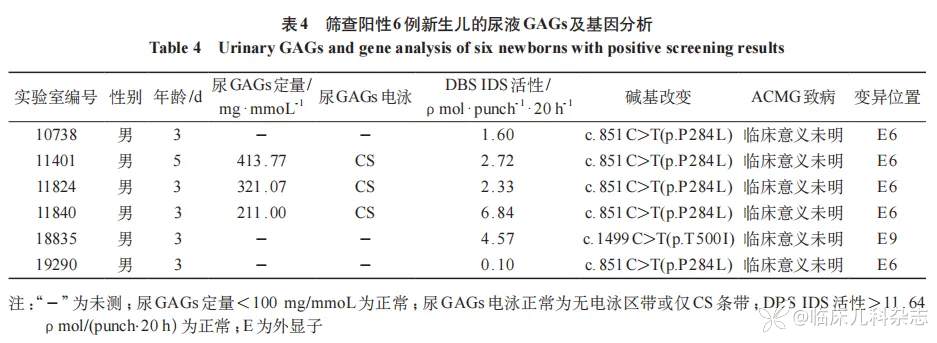
6 例可疑阳性新生儿均进行了基因检测,发现 5 例携带母亲来源的 IDS 错义突变 c.851C>T(p.P284L),1 例携带 c.1499C>T(p.T500I)错义突变(母源性)。根据 ACMG 指南,虽然这两种突变均被判读为临床意义未明的变异,但综合尿液黏多糖定量、电泳检测结果,上述 6 例筛查阳性新生儿均判断为携带良性变异 [12]。
3 讨论
MPS Ⅱ是最常见的 MPS 类型,本病患病率存在种族和地区差异,全球出生患病率为 0.68/100000[13],亚洲人群患病率相对高于西方人群,如韩国、日本、中国台湾活产新生儿患病率分别为 0.74/100000、0.84/100000、1.07/100000,而多数欧洲国家活产新生儿患病率为(0.13~0.71)/100000。目前,美国、日本和中国台湾等地区,已将 MPS Ⅱ纳入推荐的新生儿筛查 [14]。针对 MPS Ⅱ的静脉给药的酶替代治疗已经开展了近十余年,这种酶替代治疗可改善患儿的内脏器官病变,延长寿命,但由于酶分子无法穿过血脑屏障,故对神经系统症状无明显改善作用。早期行造血干细胞移植可能对神经认知功能有一定益处 [15-16]。针对 MPS Ⅱ的神经系统病变,目前 Izcargo 已在日本上市,这是一种重组融合蛋白,它将 IDS 蛋白酶与靶向人类转铁蛋白受体的抗体融合在一起,利用转铁蛋白受体介导的转胞吞作用帮助穿越血脑屏障,从而提高 Izcargo 在大脑中的浓度 [17]。此外,脑室内注射的基因治疗、酶替代治疗等也处于临床试验阶段 [18]。鉴于 MPS Ⅱ相对高的发病率、较大的危害性和可治疗的疾病特征,有必要开展 MPS Ⅱ的新生儿筛查,实现 MPS Ⅱ的早诊断、早治疗。本研究采用 DBS 法检测 IDS 活性,在国内首次尝试该方法用于 MPS Ⅱ新生儿筛查的研究,为国内开展 MPS Ⅱ新生儿筛查奠定基础。
本研究采用 ROC 曲线在试筛人群(51 例 MPS Ⅱ患儿、15 例女性携带者及 32 例非 MPS Ⅱ患儿)中确定 DBS 法检测的血 IDS 活性最佳阈值为 9. 59ρmol/(punch·20 h),其灵敏度为 100%、特异度为 22.7%,AUC 为 0.962(0.928~0.995);进一步与白细胞法进行一致性检验,Kappa 为 0.96,提示两种方法对 IDS 活性检测有很好的一致性,由此提示采用 DBS 法进行新生儿 MPS Ⅱ型筛查是可行的。但试筛人群均为学龄前期儿童以及成年人,而新生儿血白细胞计数高,DBS IDS 活性可能高于试筛人群,因此参照相关研究 [19],即筛查阳性定义为 IDS 活性浮动切值 ≤ 中位数的 20%,确定阳性切值为 11.64ρmol/(punch·20 h),在 98 例试筛人群中进行白细胞法与 DBS 法的一致性检验分析,Kappa= 0.98。
人类基因变异数据库中已报道 IDS 基因变异超过 660 种,以点突变为主,其他包括剪切位点突变、小片段或大片段的插入、缺失及真假基因重组等。IDS 基因外显子 9 的突变位点相对较多,基因型、酶活性与表型具有一定的相关性 [14]。本研究对 2022 例男性新生儿进行筛查,使用两种阳性切值,均筛查出 6 例 MPS Ⅱ阳性,经基因检测验证,5 例携带 c.851C>T(p.P284L) 突变,1 例携带 c.1499C>T(p.T500I) 突变。P284 残基结构远离活性位点,因此突变体 p.P284L 对 IDS 蛋白的结构和功能影响不大 [12]。由于 MPS Ⅱ患儿的尿 DS 和 HS 浓度增加 [20-21],本研究进一步对临床携带 c.851C>T(p.P284L)突变患儿运用串联质谱法定量分析尿 GAGs,发现 DS、HS 均低于正常参考值,排除了 MPS Ⅱ的可能性。考虑患儿尿 GAGs 定性和电泳结果为「阴性」,而白细胞 IDS 活性降低,突变体的表型也可能是 MPS Ⅱ的轻型,提示需要采用晨尿准确地定量复查 GAGs 分析结果和对可疑患儿进行较长时间随访观察 [22-23]。这些筛查阳性的患儿,虽然不是 MPS Ⅱ患儿,但均在 MPS Ⅱ基因上发现了突变位点,这些位点突变不足以严重破坏 IDS 酶活性达到疾病状态,但或多或少影响了酶活性,这进一步提示 DBS 法测得的 IDS 活性用于 MPS Ⅱ新生儿筛查,具有较强的灵敏度。
本研究中,无论以 ROC 曲线确定的最佳阈值,还是参照相关研究拟定的阳性切值,均未筛检到 MPS Ⅱ患儿,MPS Ⅱ为罕见病,本研究纳入样本量小,是原因所在。今后的研究中,需要进一步增加筛查样本量,建立更加准确的参考值范围,增强 DBS 法检测 IDS 活性筛查 MPS Ⅱ的效能,更好地甄别假阳性和真患者。
目前 MPS Ⅱ型没有商品化试剂盒。本研究建立 MPS Ⅱ型 DBS 筛查方法,利用人工合成底物 4MU-IDUS 与血样中的 IDS 反应,释放出的产物 4 -甲基伞形酮,在碱性条件下酚羟基发生解离产生荧光,荧光强度与其酶活性成正比。因此血样中水解酶的活性越高,水解底物释放的 4 -甲基伞形酮的量越多,通过荧光检测产生的荧光强度也越高,从而实现对水解酶活性的定量检测。本方法检测可重现性好、操作简便。另外,因考虑底物成本问题,本研究将原方法进行改良,在不影响检测结果情况下,将底物浓度稀释 5 倍,降低试剂成本 80%。
综上,典型 MPS Ⅱ患儿中枢神经系统受累明显,在不可逆转的神经系统受累之前开始治疗,患儿可能获得最佳益处,而新生儿疾病筛查使得 MPS Ⅱ型患儿能够实现早诊断、早治疗。本研究是对上海地区新生儿 MPS Ⅱ筛查的初步探讨,今后还需更多样本进行验证。
好文章,需要你的鼓励
















