2025 年 8 月 22 日至 23 日,由中国北京健康促进会与广州市红棉肿瘤和罕见病公益基金会联合主办、北京陆道培血液病研究院承办的第十三届陆道培血液病学术大会在京隆重召开。本次会议汇集全球顶尖血液学专家,聚焦造血干细胞移植、细胞治疗、血液肿瘤精准诊疗等核心议题,为千余名参会者呈现了一场高规格、深层次的学术盛宴。会议期间,陆道培医院曹星玉主任分享了「皮肤 T 细胞淋巴瘤治疗和造血干细胞移植进展」的精彩报告。《肿瘤瞭望-血液时讯》特整理学术内容,以期为优化临床管理策略提供重要的实践指导与理论参考。

01. 皮肤 T 细胞淋巴瘤概述(蕈样霉菌病与 Sezary 综合征)
结外淋巴瘤占非霍奇金淋巴瘤(NHL)的 30%,其中最常受累部位为胃肠道,其次为皮肤。原发性皮肤淋巴瘤根据 WHO 和 EORTC 分类,分为皮肤 T/NK 细胞淋巴瘤(CTCL)和皮肤 B 细胞淋巴瘤(CBCL)。CTCL 是一组源于皮肤归巢或皮肤驻留 T 细胞的异质性 NHL,占原发性皮肤淋巴瘤的 70%~82%,而 MF 和 SS 占所有新诊断 CTCL 病例的 70%~75%。
MF 是最常见的 CTCL,占原发性皮肤淋巴瘤的 50%,属于惰性疾病;SS 少见,在所有皮肤 T 细胞淋巴瘤中占比小于 5%,为侵袭性疾病,传统上被认为是 MF 的变异型,但目前 WHO-EORTC 基于两者临床表现和起源细胞的差异,将其视为独立疾病。MF 和 SS 的诊断中位年龄为 55-60 岁,均主要来源于辅助性 T 细胞(Th2),且随病情进展 Th2 优势愈发显著。
TNMB(肿瘤、淋巴结、器官、血液)分期系统是 MF 和 SS 最重要的预后评估工具,约 70% 的病例确诊时处于早期(IA-IIA 期)。IA 期和 IB 期患者的 5 年总生存率(OS)分别为 96%~99% 和 75%~86%,早期疾病以皮肤定向治疗为主,如局部皮质类固醇、局部氮芥、光疗和放射治疗。晚期 CTCL(≥ IIB 期)预后显著较差,需采用全身性治疗,常用药物包括贝沙罗汀、伏立诺他、罗米地辛、维布妥昔单抗(适用于 CD30+MF)和莫格利珠单抗等,但这些疗法的总体缓解率平均仅为 30%~40%,且缓解持续时间有限。
MF 起源于驻留记忆 T 细胞(TRM),表面标志物为 CCR4+、CLA+、CCR7-、L 选择素-,恶性 T 细胞局限于皮肤固定斑块; SS 起源于中央记忆 T 细胞(Tcm),表面标志物为 CCR4+、CCR7+、L 选择素 +,恶性 T 细胞可见于皮肤各区域,并在血液和淋巴结中聚集。表面分子表型与临床表型及皮肤疾病形态直接相关,这一特征为疾病诊断和治疗靶点选择提供了依据。
02.MF 与 SS 的临床与病理特征
MF 于 1806 年由 Jean-Louis-MarcAlibert 首次描述,因皮肤肿瘤结节形似蘑菇而得名。组织学上以具有曲折细胞核的中小型嗜表皮性 CD4+T 淋巴细胞增殖为特征。大多数患者为成年人或老年人,儿童和青少年亦可发病,男女比例为 2:1。全球发病率约为 10 例/100 万人口,地区差异明显,黑人发病率较高。MF 发病风险升高与环境因素可能参与发病;肥胖和吸烟史 ≥ 40 年也会增加 MF 风险。
经典 MF 表现为惰性 CD4 +淋巴瘤,初始症状为皮肤鳞屑性红斑,经多年缓慢演变为斑块和/或肿瘤,好发于躯干、臀部及大腿等非曝光部位。不足 1/3 患者会出现淋巴结受累、内脏受累及后期的大细胞转化,临床病程可持续数年甚至数十年,从斑片阶段逐步进展为浸润性斑块,最终形成肿块。
SS 临床与病理特征
SS 于 1938 年由 AlbertSezary 和 YvesBouvrain 首次报道,是 CTCL 的白血病变体,几乎仅发生于成人,以年龄大于 60 岁的男性患者为主。典型特征为红皮病、淋巴结肿大和外周血中出现核呈脑形的 Sézary 细胞。
患者除红斑和全身淋巴结病外,还可出现瘙痒、脱发、眼睑外翻、棕榈或足底角化过度症及甲营养不良。由于正常 T 细胞谱系偏斜和正常循环 CD4 +细胞丧失导致免疫失调,SS 患者继发性皮肤和全身恶性肿瘤的发病率升高。SS 属于侵袭性疾病,中位生存期为 32 个月,5 年总生存率为 10%~30%,具体取决于疾病分期。
SS 诊断需同时满足以下条件:外周血涂片 Sézary 细胞>1000 个/μL;外周血淋巴细胞免疫表型显示 CD4/CD8>10、CD4+CD7-≥ 40% 或 CD4+CD26->30%;皮肤和外周血中检测到克隆相关的 T 细胞受体基因重排(同一克隆)。其中,皮肤和血液中 T 细胞单克隆群体的检测是诊断 SS 的必要条件,需结合至少 1 项形态学或免疫表型异常方可确诊。
早期 MF 诊断标准
国际皮肤淋巴瘤学会(ISCL)和 EORTC 皮肤淋巴瘤小组提出早期 MF 诊断评分系统,包含临床特征和免疫病理学标准,当总分 ≥ 4 分时,即可诊断早期 MF。

临床分期系统
临床分期基于皮肤(T)、淋巴结(N)、内脏(M)、血液(B)的受累情况划分,具体包括 IA 期、IB 期、IIA 期、IIB 期、IIIA 期、IIIB 期、IVA 期、IVB 期,各期对应不同的 T、N、M、B 状态,为治疗方案选择和预后评估提供基础。

长期预后
基于诊断时临床分期(IA-IV 期)的 525 例患者生存分析显示,不同分期患者的预后差异显著:T3 或 T4 期患者中约半数死于疾病,而 T1 期和 T2 期患者中分别仅 2% 和 15% 死于疾病;T1 期患者占缓解期存活患者的大多数,T4 期患者获得持续临床缓解的可能性最低,78 例 T4 期患者中仅 3 例(4%)无病存活。早期疾病(IA-IIA 期)占 MF/SS 病例的 78%~93%,晚期疾病(≥ IIB 期)占 7%~22%。长期预后数据显示,IIB 至 IVB 期患者中位 OS 欠佳,充分体现了分期对预后的重要影响。
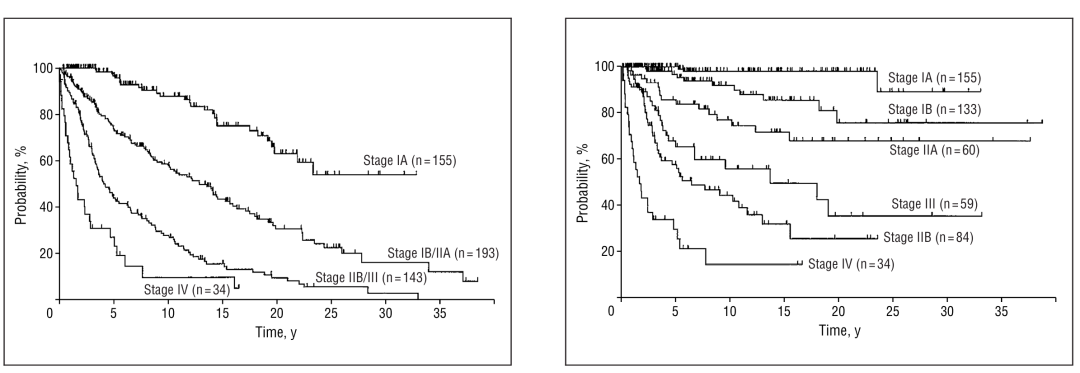
预后模型
针对进展期 MF(IIB-IV 期)/SS 患者,基于 29 个国际研究中心的 1275 例患者数据,建立了含风险因素的预后指数模型,包括 IV 期,年龄>60 岁,大细胞转化,LDH 升高 4 个危险因素分为低风险组,中风险组和高风险组。
低风险组(0-1 项风险因素)5 年生存率 67.8%,中位 OS 未达到;中风险组(2 项风险因素)5 年生存率 43.5%,中位 OS 为 46.4 个月,风险比(HR)为 2.09;高风险组(3-4 项风险因素)5 年生存率 27.6%,中位 OS 为 34.2 个月,HR 为 2.91。
03. 治疗策略
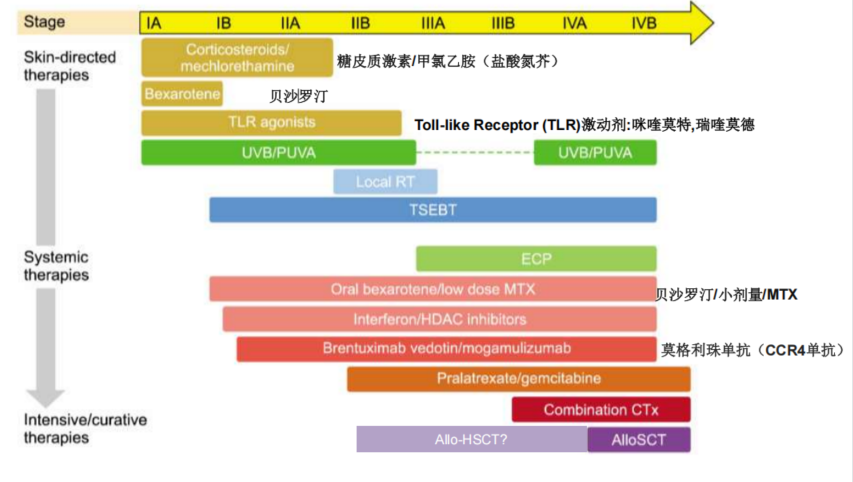
非造血干细胞移植(非 HSCT)治疗
皮肤局部治疗
包括外用超强效皮质类固醇、贝沙罗汀凝胶、氮芥/甲氯乙胺盐酸盐凝胶、咪喹莫特乳膏、他扎罗汀乳膏(外用维 A 酸类药物)、窄谱 UVB、补骨脂素 UVA,以及局部外电子束、近距离放射治疗、全皮肤电子束治疗(TSEBT)。
系统治疗
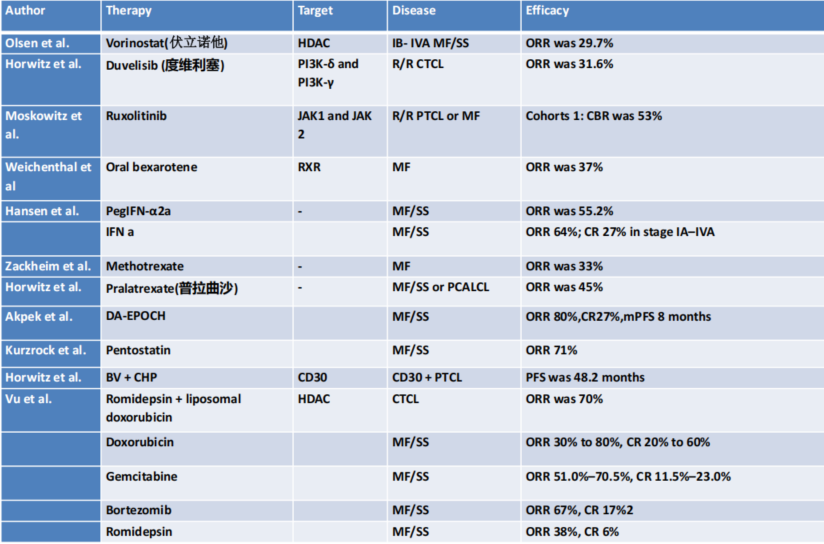
不同系统治疗药物的疗效存在差异,主要包括普拉曲沙/吉西他滨、口服贝沙罗汀/小剂量甲氨蝶呤(MTX)、干扰素/组蛋白去乙酰化酶(HDAC)抑制剂、维布妥昔单抗、莫格利珠单抗(CCR4 单抗),以及强化化疗或联合化疗方案等。其中,免疫治疗通过靶向特定分子发挥作用,常用方案包括阿伦单抗、维布妥昔单抗、莫格利珠单抗、拉可妥单抗、帕博利珠单抗、纳武利尤单抗等。
CD5CAR-T 细胞治疗难治复发的成熟 T 细胞淋巴瘤的 I 期研究(NCT0308190)纳入了 MF/SS,血管免疫母细胞性 T 细胞淋巴瘤(AITL)、PTCL 等患者,结果显示,总缓解率(CR+PR)为 44%,2 例患者达 CR,提示该疗法对部分难治患者可能有效,但是 1 例 MF/SS 和 1 例 CTCL 患者均为缓解,因此在 CTCL 的领域,CD5CART 但仍需进一步研究验证。
造血干细胞移植(HSCT)治疗
auto-HSCT
回顾性分析显示,自体造血干细胞移植(auto-HSCT)虽能使大部分患者获得缓解(ORR 较高),但 75% 的患者在中位移植后 2.3 个月复发,长期疗效不佳。MetA 分析对比 20 例 Allo-HSCT 和 19 例 Auto-HSCT 患者,两组基线特征(性别、年龄、疾病分期)相似,但 Allo-HSCT 组的 OS 和 PFS 均显著优于 Auto-HSCT 组,且 Allo-HSCT 组 70% 存在持续性移植物抗宿主病(GVHD),多为轻至中度。
allo-HSCT
多项研究证实 Allo-HSCT 是进展期 CTCL 的有效治疗手段。EBMT 长期随访数据(n = 60)显示,疾病复发/进展是移植后失败的主要原因,27 例患者(45%)在移植后中位 3.8 个月(1-59 个月)复发,仅 2 例在移植 2 年后复发(3 年和 5 年);27 例复发患者中 8 例在移植后中位 8 年(1 年 7 个月至 10 年)仍存活,提示供体淋巴细胞输注(DLI)和/或挽救性治疗可使部分患者获益。清髓性预处理(MAC)与较高的非复发死亡率(NRM)相关,且降低 OS(HR = 2.99,95%CI 1.40-6.36,P = 0.0046),而降低强度预处理(RIC)与更高复发率无显著关联。
预后因素
EBMT 针对 CTCL 异基因造血干细胞移植的多因素分析显示,多种临床指标与移植预后密切相关。卡氏功能状态评分(Karnofsky PS)差的患者,其非复发死亡率(NRM)显著升高,而对复发率、无进展生存期(PFS)及总生存期(OS)无显著影响。供者类型方面,无关供者(URD)相比 HLA 相合同胞供者,OS 显著降低,但对 NRM、复发率及 PFS 无明显影响。移植时疾病状态是关键预后因素,进展期患者的 NRM、复发率显著升高,PFS 和 OS 显著缩短。在移植前达到 VGPR 或 CR 的患者 allo-HSCT 2 年 OS 达 74%。T 细胞去除治疗可降低 NRM,但有增加复发率的趋势,对 PFS 和 OS 无显著影响。预处理方案中包含全身照射(TBI),可降低复发率,对其他预后指标无显著影响。清髓性预处理(MAC)与非清髓性预处理相比,对各项预后指标均无显著影响。
此外,移植物抗肿瘤(GVT)效应在发生大细胞转化(LCT)之前更为显著,这一结论得到 Hosing 前瞻性研究队列数据的支持,该研究显示伴 LCT 的 MF 患者 4 年无进展生存率仅为 8.6%。
预处理方案
预处理方案目前尚无标准方案。国际血液和骨髓移植研究中心(CIBMTR)数据显示,预处理方案呈现明显多样性。常用的方案包括 Flu+Mel、Flu+BU、环磷酰胺(Cy)+TBI、TLI+ATG 及 BEAM 方案等。来自一项日本北海道大学医院的研究 3 年 OS 为 85.7%。
日本一项纳入 48 例患者的多中心研究患者中位年龄 45.5 岁,25% 的患者移植前达 CR/PR,其余为难治复发患者。65%(31 例)的患者接受 RIC 方案,以 Flu、Mel、BU 联合低剂量 TBI(2-4 Gy)为主;35%(17 例)的患者接受 MAC 方案,其中 15 例采用 TBI(12 Gy)联合 Cy(120 Mg/kg)。研究发现,绝大部分患者的死亡原因是疾病进展,且移植后 16 个月内未再出现疾病进展病例,提示预处理方案的选择需结合患者疾病状态和身体耐受性综合判断。
桥接方案
在 CTCL 患者接受 allo-HSCT 前,采用有效的桥接治疗以达到理想的疾病缓解状态,是改善移植预后的关键环节。目前临床中常用的桥接方案主要包括三类:一是维布妥昔单抗联合苯达莫司汀方案;二是全皮肤电子束放疗(TSEBT);三是自体造血干细胞移植(auto-HSCT)序贯 Allo-HSCT 的序贯移植方案。
莫格利珠单抗作为一种靶向 CCR4 的单克隆抗体,在 CTCL 治疗中具有一定疗效,但多项研究证实其在 Allo-HSCT 前使用会显著增加移植物抗宿主病(GVHD)的发生风险。研究发现,尽管莫格利珠单抗的半衰期约为 16-18 天,但其在体内可导致调节性 T 细胞(Treg)耗竭,且该耗竭效应可持续半年以上,而 Treg 对维持免疫耐受、抑制 GVHD 发生至关重要。
程序性死亡受体 -1(PD-1)单抗作为免疫检查点抑制剂,在多种恶性肿瘤治疗中显示出抗肿瘤活性,但在 Allo-HSCT 前使用同样会增加 GVHD 风险。多项临床研究数据显示,aGVHD 发生率普遍较高,为 33%~100%,cGVHD 发生率为 9%~41%。因此,临床在制定治疗方案时需充分权衡其抗肿瘤获益与 GVHD 风险。
非移植和移植的比较
CUTALLO 试验是一项前瞻性多中心匹配对照研究,纳入法国 30 家医院的 18-70 岁进展期 MF/SS 患者。HSCT 组有合适供者(同胞或 HLA 匹配无关供者)的患者接受 RIC Allo-HSCT,结果显示,HSCT 组的 PFS 显著优于非 HSCT 组,OS 亦有改善趋势;匹配后分析显示非 HSCT 组疾病复发更频繁,且 HSCT 组患者生活质量评分随时间上升,进一步证实 Allo-HSCT 对进展期 CTCL 的治疗价值。
总 结
综合现有临床证据,MF 和 SS 作为 CTCL 的主要亚型,常规药物治疗(包括化疗、靶向药物等)尚无法实现治愈,仅能控制疾病症状、延长缓解时间。其中 MF 虽属于惰性淋巴瘤,但当疾病进展至 ≥ IIB 期后,预后显著变差,患者生存期明显缩短;而 SS 作为侵袭性较强的亚型,无论初始分期如何,均需积极治疗以改善预后。基于现有疗效数据,对于 MF ≥ IIB 期和 SS 患者,allo-HSCT 是目前可能实现长期疾病控制甚至治愈的治疗手段,应作为重要治疗选择纳入临床考量。不推荐 auto-HSCT。
在 Allo-HSCT 预处理方案选择方面,需根据患者年龄、身体基础状况、疾病状态等个体化因素综合判断,其中 RIC 方案因能显著降低 NRM,尤其在减少感染相关死亡风险方面具有优势,可作为首选方案。移植前获得 CR 或 PR 是保障 Allo-HSCT 疗效的关键前提,临床可通过 TSEBT 等桥接方案,帮助患者达到理想缓解状态。此外,allo-HSCT 后需密切监测原发病复发情况,一旦出现复发,及时采用供体淋巴细胞输注(DLI)干预,可有效发挥 GVT 效应,改善患者预后,延长无病生存期。
参考文献:
1.NCCN Guidelines.Primary Cutaneous Lymphomas Version 1.2025 -November 11, 2024
2.WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues Revised 4th EditionFront Oncol. 2023 Apr 14:13:1141108. Chin Clin Oncol. 2019 Feb;8(1):12
3.Chin Clin Oncol. 2019 Feb;8(1):12.
4.Hematol Oncol Clin North Am. 2019.33(1): 103–120
5.Front Oncol. 2023 Apr 14:13:1141108.
6. 中国蕈样肉芽肿诊疗及管理专家指南. 罕见病研究.2023.2(2):191-209.
7.J Am Acad Dermatol. 2005 Dec;53(6):1053-63.
8.Arch Dermatol.2003.139(7):857-66
9.Blood Res 2023;58:S66-S82
10.Br J Haematol. 2021.195(3):352-364.
11.Cancer Manag Res. 2023 Sep 6:15:989-998.
12.Am J Clin Pathol 2015;143:57-69
13.Blood. 2024 Mar 28;143(13):1231-1241.
14.Bone Marrow Transplant 2008;41:597-604.
15.Biol Blood Marrow Transplant. 2009 Aug;15(8):982-90.
16.Bone Marrow Transplant 2008;41:597-604.
17.Biol Blood Marrow Transplant. 2020 Jan;26(1):76-82.
18.J Clin Oncol. 2014 Oct 10;32(29):3347-8
19.Lancet. 2023 Jun 10;401(10392):1941-1950.
20.Bone Marrow Transplantation (2021) 56:1391–1401
21.Haematologica. 2014.99(3):527-34
22.Annals of Oncology 26: 2490–2495, 2015
23.Annals of Hematology (2018) 97:1041–1048
24.Bone Marrow Transplant. 2014 November ; 49(11): 1360–1365
25.Hematol Oncol 2016; 34:9–16
26.Hematol Oncol. 2020 Aug;38(3):266-271.
27.Hematology Am Soc Hematol Educ Program. 2021(1):303-312.
28.Cancers (Basel). 2020 Oct 3;12(10):2856.
29.JAMA Dermatol. 2018 Jun 1;154(6):728-730.
30.J Clin Oncol. 2016 Oct 1;34(28):3426-33.
31.Biol Blood Marrow Transplant. 2019 Jan;25(1):94-99.
好文章,需要你的鼓励
















