近日,国际著名期刊 Nature Communications(《自然 通讯》IF = 16.6)发表了武汉大学人民医院(湖北省人民医院)肿瘤中心张平锋教授团队的最新研究成果。该研究通过突变体实验验证了 DltB 四聚体在转运和催化双功能中的关键作用,发现细菌细胞壁中脂磷壁酸 D-丙氨酸化的转运和催化新机制,为研发治疗「超级细菌」的新型抗生素提供了重要理论基础。

Nature Communications 是《自然》杂志旗下的高级综合性刊物,被中科院划分为 1 区 TOP 期刊,JCR 分区 Q1。论文题目为《Structural insights into the transporting and catalyzing mechanism of DltB in LTA D-alanylation》,张平锋教授是第一作者和首要通讯作者,本研究的大部分实验在武汉大学人民医院肿瘤中心实验室完成。 该研究得到了人民医院肿瘤中心宋启斌教授,姚頤教授以及美国乔治城大学裴华东教授的大力支持。
基因突变和抗生素滥用导致了抗药性「超级细菌」的产生,这是一个全球性问题,对医疗系统构成了严峻挑战。世界卫生组织 (WHO) 已发布警告,强调耐药性病原菌对人类公共卫生的重大威胁。传统抗生素通常作用于细菌细胞壁肽聚糖的合成、蛋白质合成、核酸合成等途径。然而随着耐药性的产生,迫切需要针对新的靶点研发新型抗生素。但这一领域的进展相对缓慢,主要受限于合适的新靶点很少。
张平锋教授介绍,常见的「超级细菌」包括耐甲氧西林金黄色葡萄球菌(MRSA)、耐万古霉素肠球菌(VRE)和耐药性结核分枝杆菌等多种格兰仕阳性细菌。
格兰仕阳性细菌的细胞壁主要由肽聚糖(PG)和磷壁酸(TA)构成。一类常用的β-内酰胺类抗生素,主要通过抑制肽聚糖的合成来发挥抗菌效果,而目前尚未开发出针对磷壁酸的抗生素。DltB 蛋白是 MBOAT 超家族中的细菌膜蛋白,在脂磷壁酸(LTA)的 D-丙氨酸化(D-ala)修饰中起关键作用。
这个修饰可稳定细胞壁结构,对细菌适应环境、增强致病性和影响宿主免疫反应等多方面具有重要意义。然而 DltB 在该修饰过程中的分子机制一直未被完全揭示。特别是 D-丙氨酸在细胞内合成,而 LTA 的 D-丙氨酸化修饰发生在细胞外,底物如何被转运到细胞外的机制仍然不明确。

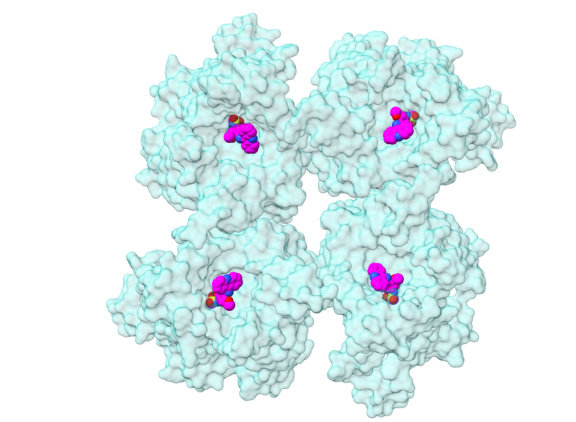
张平锋教授团队利用冷冻电镜单颗粒分析方法,解析了 DltB 蛋白四聚体的高分辨率结构,以及与 DltC 复合物和抑制剂 AMSA 的复合物结构。研究首次揭示了 DltB 在细胞膜上形成有功能的四聚体,并解释了 DltC 如何从细胞内将 D-丙氨酰基递送至靠近 DltB 的活性中心,DltB 四聚体通过构象变化打开通道,从而把 D-丙氨酰基转运至细胞外表面,并转移至结合在 DltB 底物结合位点的 LTA 上。
该研究通过突变体实验,验证了 DltB 四聚体在转运和催化双功能中的关键作用。此外,研究还发现抑制剂 AMSA(紫色球状模型)通过与 DltB 单体细胞外表面上的芳香族氨基酸簇结合,展现了高亲和力的结合方式;由于结合位点在细胞外表面,利于开发新型抗生素。
值得一提的是,由于 LTA 的 D-丙氨酸化修饰决定了很许病原菌的致病性,抑制该修饰降低致病性而不影响细菌的生存,因此靶向该通路可能有助于避免产生新的耐药性。
张平锋教授与武汉大学人民医院肿瘤中心宋启斌教授、姚颐教授以及美国乔治城大学的裴华东教授团队已经在 Nature Chemical Biology,Molecular Cell 和 Cancer Letters 等杂志上发表 3 篇高水平研究论文。
好文章,需要你的鼓励
















