近期,西南医院神经内科主任周振华教授为最后通讯作者,袁继超主治医师为第一作者的原创性研究论著「Targeted Treatment of Ischemic Stroke by Bioactive Nanoparticle-Derived Reactive Oxygen Species Responsive and Inflammation-Resolving Nanotherapies(一种生物活性衍生的具有自由基响应性及炎症调控释放的纳米材料靶向治疗缺血性脑卒中)」在国际权威期刊 ACS Nano 杂志(IF = 15.881)在线发表。这是西南医院神经内科周振华主任团队在纳米药物靶向治疗缺血性脑卒中领域的原创性科研成果。
急性缺血性脑卒中是致死率和致残率最高的疾病之一,尽管静脉溶栓和支架取栓可以促进血供恢复,由于其较短的治疗时间窗导致大部分患者只能接受保守治疗,但目前临床缺乏有效的治疗药物。炎症反应介导的缺血半暗带神经元凋亡是导致功能丧失的根本原因,抑制炎症反应可有效挽救残存神经元。大量动物实验证实了多种抗炎药物对急性缺血性脑卒中后运动功能的改善,但临床试验均以失败告终,究其原因是血脑屏障的存在。
该研究团队与陆军军医大学药学与检验医学系药剂教研室张建祥主任团队展开合作,将具有自由基清除作用的化合物 (Tempol) 和苯基硼酸频哪醇酯 (PBAP) 共价结合在β-环糊精上,制备了一种能有效穿透血脑屏障且具有抗氧化和抗炎活性的低聚糖纳米材料 (TPCD NPs)。
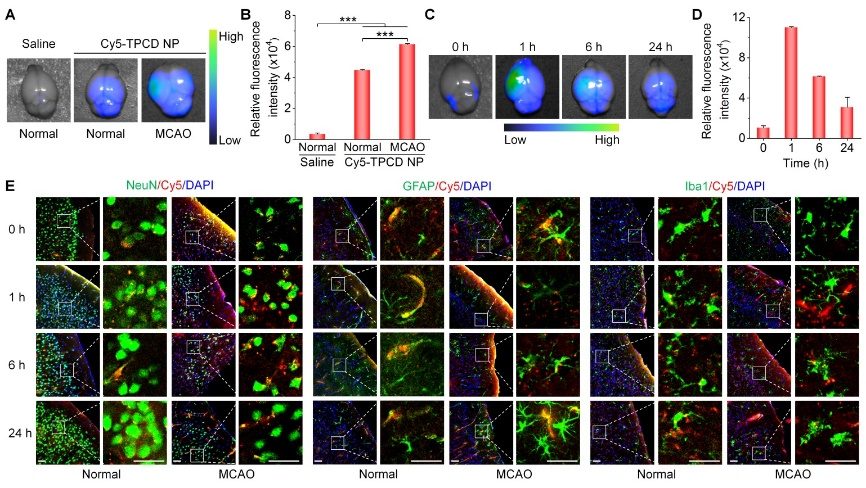
该研究结果显示,TPCD NPs 能在梗死脑组织中有效聚集,缺血组织产生的氧自由基介导其分解后主要被小胶质细胞吞噬,证明其能穿透血脑屏障,靶向到达缺血部位,通过抗炎抗氧化作用减少缺血半暗带神经元凋亡,从而改善小鼠运动功能。同时,TPCD NPs 通过负载一种具有抗炎作用的多肽 Ac2-26(ATPCD NPs)后进一步改善了小鼠运动功能,证实其相较于 TPCD NPs 可发挥更强的抗炎抗氧化作用。初步体内外评价表明该纳米疗法具有良好的生物安全性。
本研究结合炎症反应导致神经元凋亡的致病机制,针对现有的治疗药物无法有效穿透血脑屏障的特点,研发了一种新型的具有抗炎生物学活性的纳米药物,这种由 TPCD NPs 衍生的纳米药物投递系统为实现靶向治疗缺血性脑卒中和其他炎症相关的神经系统疾病提供了新策略。
该研究获得国家自然科学基金、重庆市自然科学基金和陆军军医大学人才项目等资助。
好文章,需要你的鼓励
















