高尚医学影像诊断中心 病例
病史摘要
老年男性,患者 8 月前发现左前臂皮肤肿物,当时体积较小,未予重视及治疗,后逐渐长大,无疼痛。既往体健。
查体:左前臂可见一大小约 4 cm×5 cm 肿物,突出皮肤表面隆起,高出皮表约 1.5 cm,基底部固定,活度差,质地硬,边界清晰,表面无红肿热痛及破溃等,无明显压痛,肿块周围未触及肿大淋巴结。
诊疗经过:患者入院后给予完善相关辅助检查,排除手术禁忌症后行全麻下行肿瘤切除手术。
初步病理:考虑间叶源性肿瘤,淋巴瘤等不能除外
病理会诊结果:

术后半月患者发现左前臂术区及右侧腋下皮肤下软组织结节再次入院,行 PET/CT 检查评估全身肿瘤情况。
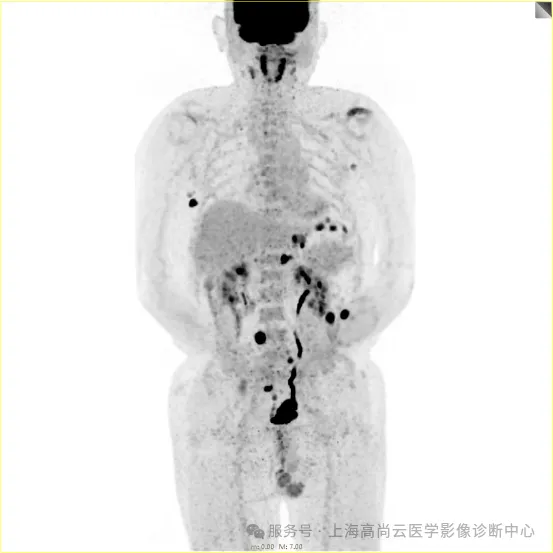
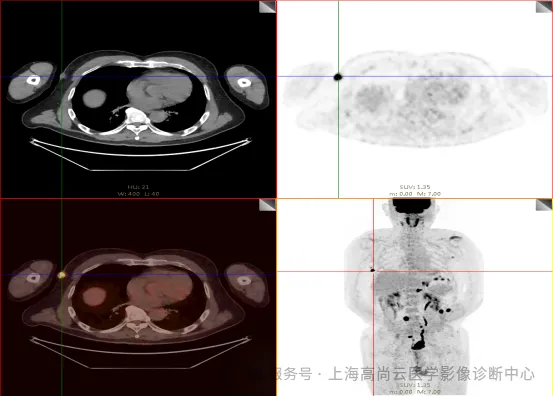
PET/CT 全身 MIP 图:
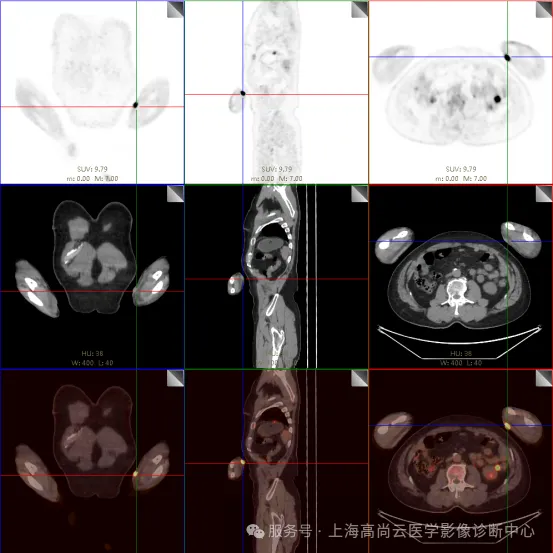
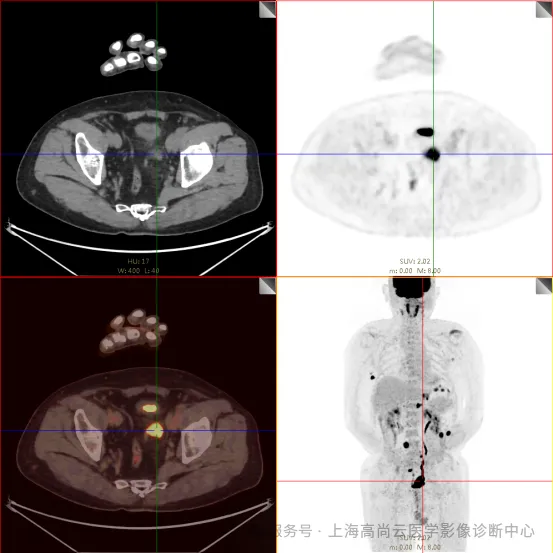
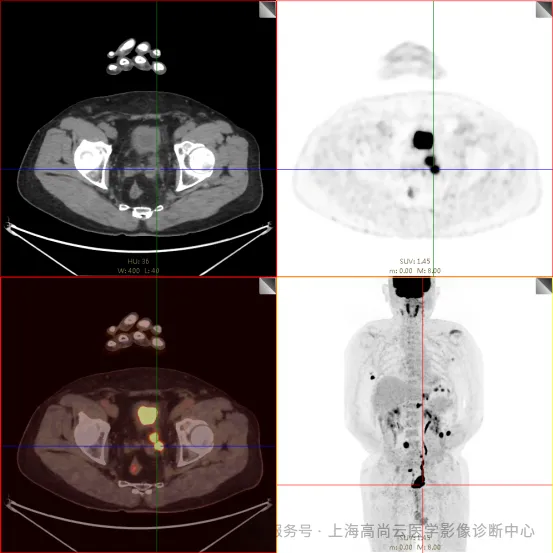
PET/CT 融合图:
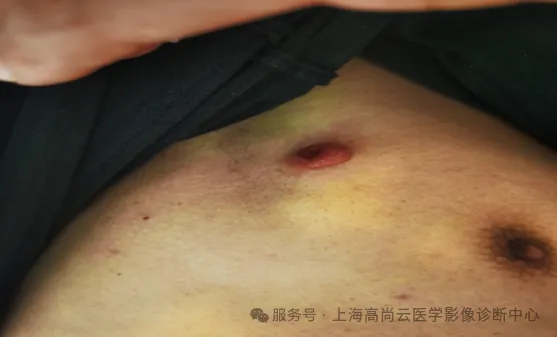
右侧腋下皮肤 FDG 高代谢病变照片
PET/CT 融合图:
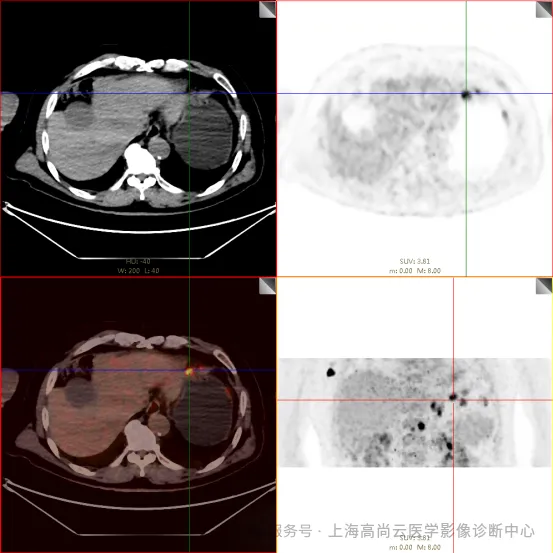
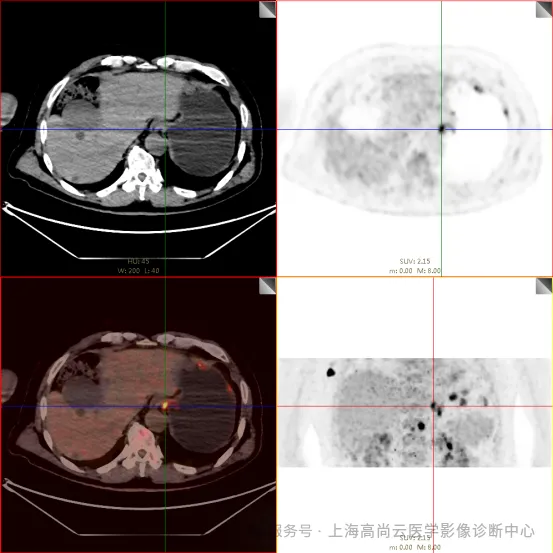
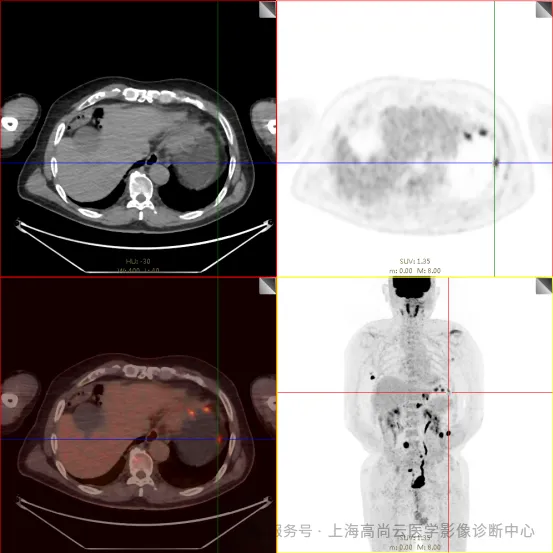
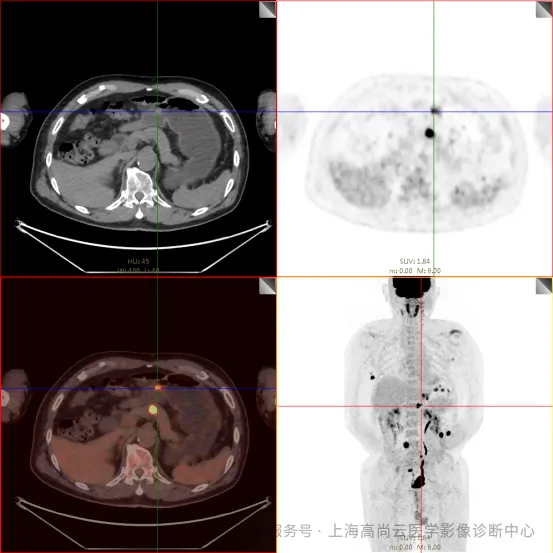
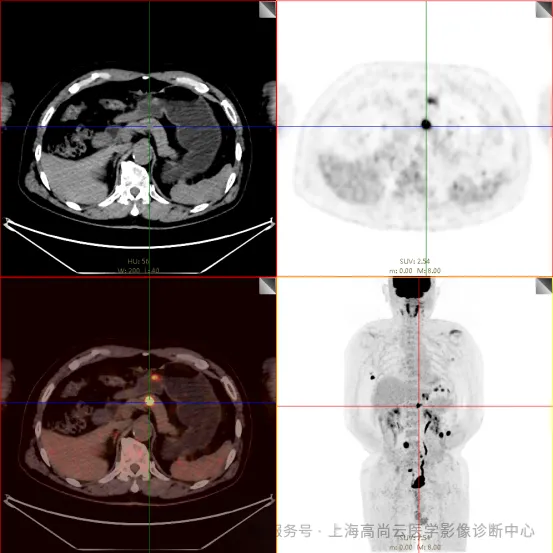
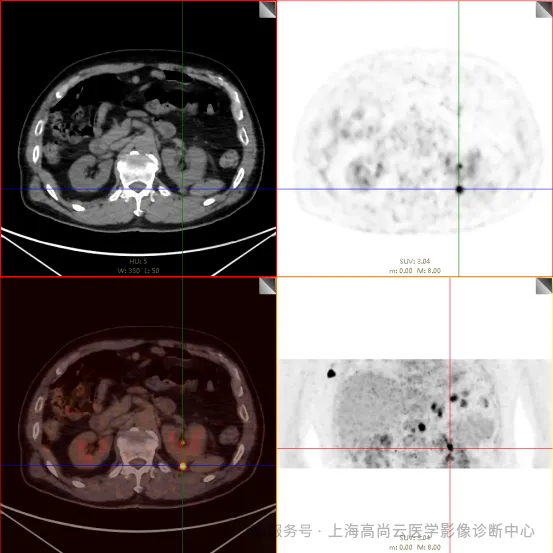
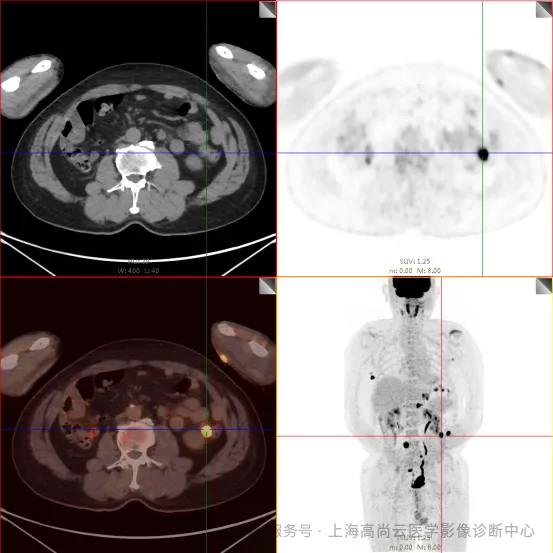
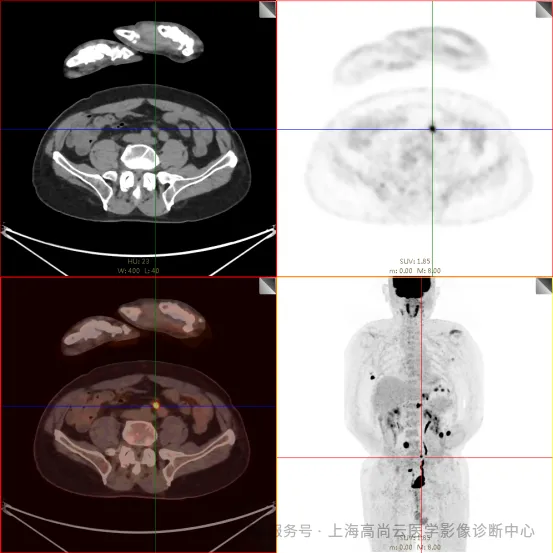
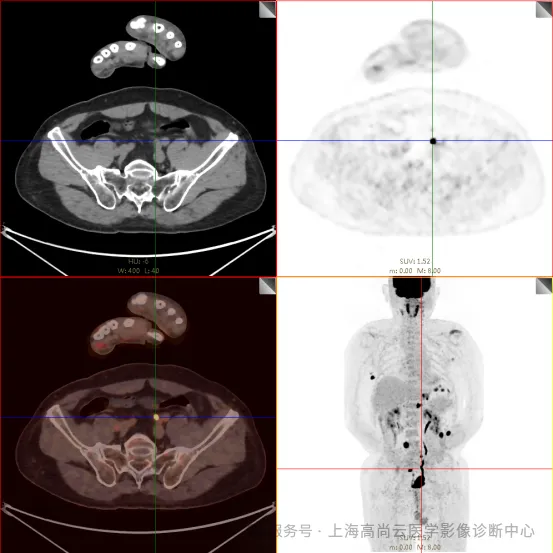
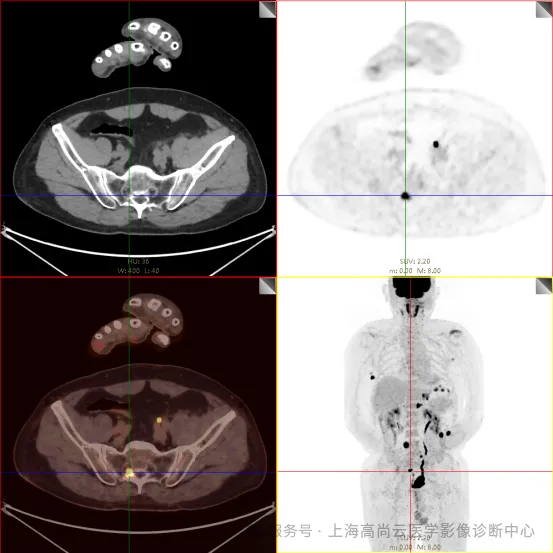
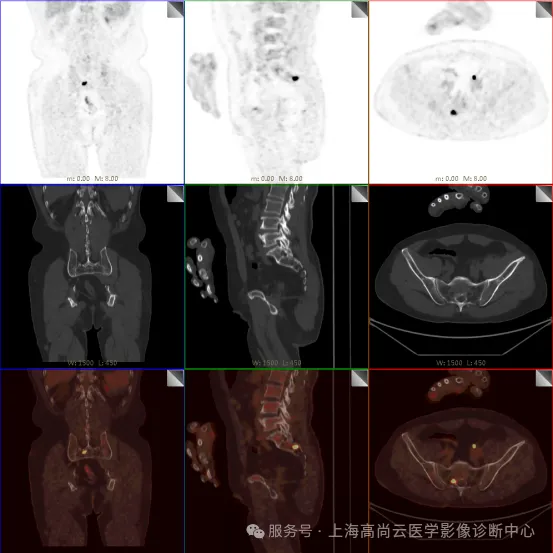
PET/CT 检查:
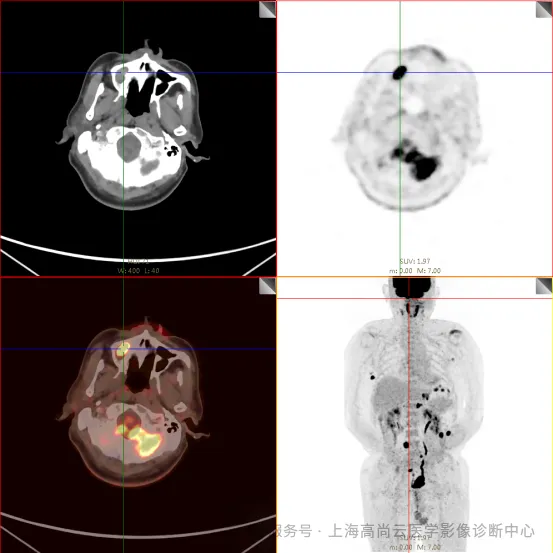
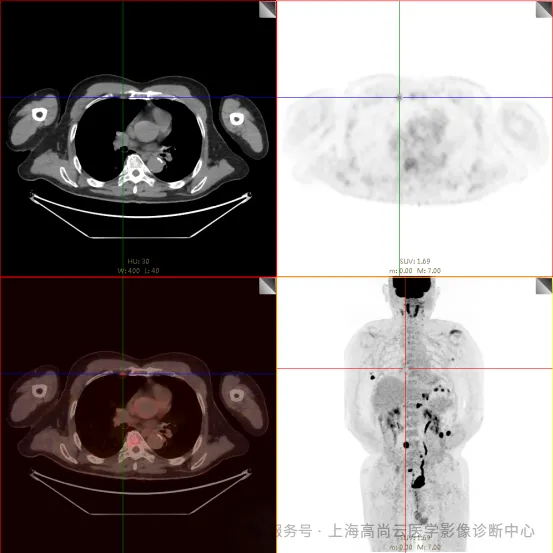
左前臂恶性肿瘤(母细胞性浆细胞样树突细胞肿瘤)切除术后,左前臂掌侧皮肤、右上侧胸壁皮肤见 2 枚结节状 FDG 摄取增高影,直径分别约 1.7 cm 及 1.4 cm,SUVmax 约为 13.8,CT 见上述部位见异常软组织结节影,边界尚清,密度均匀。左侧额窦及右侧上颌窦内见结节状 FDG 摄取增高影,较大位于右侧上颌窦底部,范围约 1.1 cm×1.7 cm,SUVmax 约为 15.4,CT 示上述部位见软组织密度影。左侧腋窝内、右侧内乳区、心前区、肝-胃间隙、左肾后间隙内、腹膜后大血管旁、左中腹结肠旁沟、髂总动脉血管分叉处、盆腔左侧壁系膜内多发大小不等淋巴结及软组织密度结节影,较大位于盆腔左侧壁,约 2.6 cm×2.4 cm×2.3 cm(上下径),该病变与邻近输尿管分界不清,FDG 摄取不同程度增高,SUVmax 约为 14.8。
骶 1 右侧骶孔内见一结节状 FDG 摄取增高影,大小约 1.0 cm×0.8 cm,SUVmax 约为 18.1,CT 示局部软组织轻度增厚影。
诊断:
1. 左前臂恶性肿瘤(母细胞性浆细胞样树突细胞肿瘤)切除术后改变:
a. 左前臂掌侧皮肤、右上侧胸壁皮肤 2 枚软组织结节伴代谢增高;
b. 左侧腋窝内、右侧内乳区、心前区、肝-胃间隙、左肾后间隙内、腹膜后大血管旁、左中腹结肠旁沟、髂总动脉血管分叉处、盆腔左侧壁系膜内多发大小不等淋巴结及软组织结节伴代谢增高。
c. 左侧额窦及右侧上颌窦内结节代谢增高影;胃壁多处结节状代谢增高影;胰体部结节状代谢增高影;骶 1 右侧骶孔内结节状代谢增高;
上述 a~c 项改变,均考虑为恶性肿瘤(肿瘤多系统浸润/转移)
2. 左侧肩周炎表现。
概述
母细胞性浆细胞样树突细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,BPDCN) 被认为是起源于浆细胞样树突细胞前体细胞的恶性肿瘤,临床行为具有高度侵袭性。BPDCN 发病率低,属于罕见肿瘤,因对该病临床表现及病理特征认识不足,易被误诊为其它类型的淋巴造血肿瘤。2001 年 WHO 淋巴肿瘤分类中被命名为母细胞 NK 细胞淋巴瘤,2022 年第 5 版 WHO 重新归为组织细胞/树突细胞肿瘤一类。
临床表现
好发于老年人,可发生任何年龄,BPDCN 发病率低, 占全部淋巴造血肿瘤比例不足 1%,该病发病有小于 20 岁及大于 60 岁两个高峰期,男女发病比例约 3.3:1。大部分 BPDCN 患者以皮肤病变为首发症状而就诊,惰性皮肤病变不改变该肿瘤高侵袭性质,随着疾病进展, 肿瘤可侵犯骨髓及外周血,小部分患者发病时即为白血病样临床表现,肿瘤累及全身多处器官。
PET/CT 应用价值
本例通过 18F-FDG PET/CT 检查可以很明确的找出和诊断术区是否存在转移及复发、特别是找出远处转移情况,本例还发现包括术区转移、皮肤转移、全身多处淋巴结转移,腹腔内脏器(胃壁及胰腺)、骨骼的小转移灶及少见的鼻窦内转移,大大提高了诊断的准确性和灵敏度,了解了全身转移情况,同时为临床活检提供精准取材部位,节省了患者治疗前诊断分期时间。
PET/CT 在诊断肿瘤方面有明显的优势,对恶性肿瘤的诊断、分期和确定合适的治疗方案,有其独特的价值和优势。
鉴别
皮肤原发 BPDCN 需与髓系肿瘤侵犯皮肤和皮肤原发 T/NK 细胞来源淋巴瘤相鉴别,累及淋巴结病变需与 T/B 淋巴母细胞淋巴瘤进行鉴别。
治疗及预后
临床上缺乏标准化的治疗方案,对常规的化疗及放疗敏感,但极易复发,预后较差。
目前治疗主要为局部放疗、化疗、造血干细胞移植、靶向治疗以及免疫治疗等,其中化疗方案主要以治疗淋巴瘤、急性淋巴细胞白血病及急性髓系细胞白血病化疗为基础,异基因造血干细胞移植可改善预后,但复发率仍很高。
参考文献
李春艳 方雅兰 刘国荣 常丽君 陈少红 丁文双《母细胞性浆细胞样树突细胞肿瘤临床病理特征分析》广州医药 2023 年 3 月第 54 卷第 3 期
RIAZ W, ZHANG L, HORNA P, et al. Blastic plasmacytoid dendritic cell neoplasm: update on molecular biology, diagnosis, and therapy [J]. Cancer Control, 2014, 21 (4): 279-289.
TSAGARAKIS N J, PATERAKIS G. Dendritic cell leukemia: a review [ J ]. Curr Oncol Rep, 2020, 22 (6): 55.
ADNAN A, POWELL P R, STAPLES C J, et al. Blasticplasmacytoid dendritic cell neoplasm: a case series andreview [J]. Am J Dermatopathol, 2021.
ZHANG Y, XIONG J, LI S, et al. Cutaneous manifestations of blastic plasmacytoid dendritic cell neoplasm: aretrospective study of morphological and immunophenotypic features [J]. Eur J Dermatol, 2022, 32 (1): 70-76.
KERR D N, SOKOL L. The advances in therapy of blastic plasmacytoid dendritic cell neoplasm [ J ]. Expert
Opin Investig Drugs, 2018, 27 (9): 733-739.
SULLIVAN J M, RIZZIERI D A. Treatment of blastic plasmacytoid dendritic cell neoplasm [ J]. Hematology
Am Soc Hematol Educ Program, 2016, 2016 (1): 16-23.
BEIRD H C, KHAN M, WANG F, et al. Features of non-activation dendritic state and immune deficiency inblastic plasmacytoid dendritic cell neoplasm ( BPDCN) [J]. Blood Cancer J, 2019, 9 (12): 99.
SHI Y, WANG E. Blastic plasmacytoid dendritic cell neoplasm: a clinicopathologic review [ J ]. Arch PatholLab Med, 2014, 138 (4): 564-569.
AOKI T, SUZUKI R,KUWATSUKA Y, et al. Longterm survival following autologous and allogeneic stem cell
transplantation for blastic plasmacytoid dendritic cell neoplasm [J]. Blood, 2015, 125 (23): 3559-3562.
VENUGOPAL S, ZHOU S, EL J S, et al. Blastic plasmacytoid dendritic cell neoplasm-current insights [ J].
Clin Lymphoma Myeloma Leuk, 2019, 19 (9): 545-554.
JEGALIAN A G, BUXBAUM N P, FACCHETTI F, et al. Blastic plasmacytoid dendritic cell neoplasm in children: diagnostic features and clinical implications [ J]. Haematologica, 2010, 95 (11): 1873-1879.
SWEET K. Blastic plasmacytoid dendritic cell neoplasm: diagnosis, manifestations, and treatment [ J ]. CurrOpin Hematol, 2020, 27 (2): 103-107.
好文章,需要你的鼓励
















