


Nature Communications | 柴人杰教授团队与合作者利用碱基编辑技术恢复 DFNA15 耳聋小鼠听力功能
9 月 18 日,东南大学附属中大医院柴人杰教授团队联合多家单位在国际知名期刊 Nature Communications 上发表了题为「Optimized in vivo base editing restores auditory function in a DFNA15 mouse model」的研究论文。该研究针对由 POU4F3 基因无义突变导致的 DFNA15 显性遗传性耳聋,构建了一种精准高效型腺嘌呤碱基编辑器(ABE),并采用双腺相关病毒(dual-AAV)递送系统在耳聋小鼠模型中高效修复致病突变,显著恢复了其听觉功能,为遗传性听力损失的基因治疗提供了关键的实验依据与新的策略。
东南大学附属中大医院柴人杰教授、北京理工大学齐洁玉副教授、东南大学附属中大医院谈方志副研究员、复旦大学杨红波研究员为本文共同通讯作者。东南大学博士研究生王嫚、张紫雨,硕士研究生王晓涵以及博士后张李燕为共同第一作者。

听力损失是全球性的重大健康问题,约有 4.3 亿人受到影响。其中,超过半数的感音神经性耳聋由遗传因素导致,其病理机制多与内耳毛细胞功能障碍相关。虽然助听设备和人工耳蜗是常用的干预手段,但其疗效受限于个体残存的听觉功能,难以从根源解决问题。近年来,能够直接修复致病基因的基因编辑技术为遗传性疾病治疗开辟了新途径。
由 POU4F3 基因突变引起的常染色体显性非综合征性耳聋 DFNA15,其临床表现因突变类型不同而异。在中国人群中,已报道 POU4F3 基因的 337C>T 无义突变会导致蛋白翻译提前终止,产生功能缺失的截短蛋白,最终引发双侧进行性听力下降。然而,目前尚无有效治疗手段。
为探究 DFNA15 的基因治疗策略,研究团队首先构建了精准模拟患者渐进性听力损失表型的 Pou4f3WT/Q113*小鼠模型。通过整合 PAM 灵活且活性高的 Cas9 蛋白与优化型 TadA 脱氨酶,研究团队建立了一系列 ABE 工具箱,并在体外筛选出 SchABE8e-sgRNA3 组合,实现了目标位点的高效精准修复。
在关键的体内疗效验证中,研究团队采用 dual-AAV 系统将 SchABE8e-sgRNA3 递送至小鼠内耳。结果显示,该策略成功纠正了致病突变,恢复了 POU4F3 全长蛋白的表达及其正常核定位。功能上,听力学评估证实,经治疗小鼠的听力恢复至接近野生型水平,且疗效稳定持续至少四个月。与此同时,全基因组测序与行为学分析均表明,该疗法具有良好的生物安全性,未检测到对内耳及神经系统的脱靶效应或毒副作用。
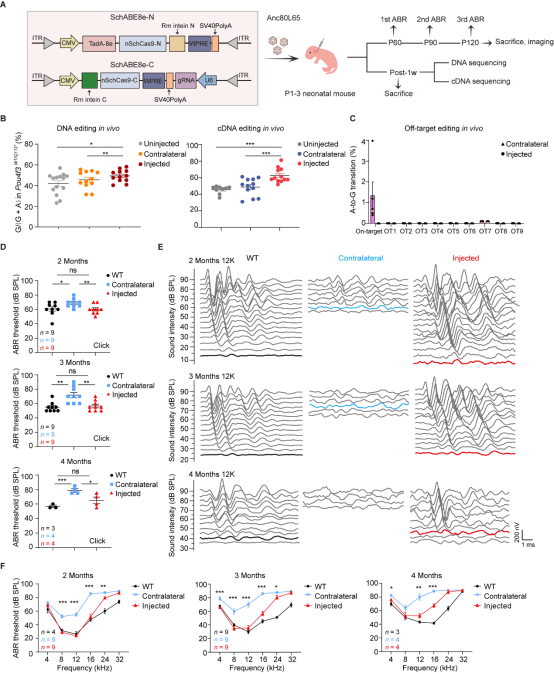
图 dual-AAV 递送 SchABE8e-sgRNA3 在 Pou4f3WT/Q113*小鼠中的疗效评估
综上,该研究不仅构建并验证了一种高效且安全的体内碱基编辑工具,更首次在显性遗传性耳聋动物模型中通过原位修复致病基因,实现了听觉功能的持久且稳定恢复。该工作为 DFNA15 的临床转化奠定了关键实验基础,也为其他遗传性疾病的治疗策略开发提供了新的思路与选择。(编辑刘敏 校对王倩 编审程守勤)
好文章,需要你的鼓励













