JSH2023 | 潘静主任大会发言:自体 CD7 CAR-T 治疗 r/r T-ALL/LBL 的Ⅰ期临床研究新进展
10 月 13 日~15 日,2023 年第 85 届日本血液学会(JSH)年会在日本东京隆重举行。作为仅次于美国血液学会(ASH)年会、欧洲血液学会(EHA)年会的世界排名第三的年度盛会,本届 JSH 年会邀请全球血液领域顶级专家与学者,共同立足领域前沿开展交流、分享与探讨,最新进展令人目不暇接。
高博医学(血液病)北京研究中心北京高博博仁医院潘静主任将聚焦自体 CD7 CAR-T 治疗难治/复发急性 T 淋巴细胞白血病/淋巴瘤(r/r T-ALL/LBL),在大会发言中分享题为「Autologous CD7 CAR T-Cell Therapy for Refractory or Relapsed T-cell Acute Lymphoblastic Leukemia/Lymphoma」的最新研究成果。
此前,潘静主任联合中国医学科学院血液病医院(中国医学科学院血液学研究所)冯晓明教授、同济大学医学院张鸿声教授已就供者来源 CD7 CAR-T 治疗 T 系肿瘤开展了一系列探索,研究成果发表于多个高水平学术期刊,受到业内广泛关注。
其中,研究「Donor-Derived CD7 Chimeric Antigen Receptor T Cells for T-Cell Acute Lymphoblastic Leukemia: First-in-Human, Phase I Trial」于 2021 年在线发表于 Journal of Clinical Oncology(IF = 45),证实了供者来源 CD7 CAR-T 在 r/r T-ALL 患者中的早期疗效。
今年,有关该项研究长期安全性与疗效持久性的 2 年随访结果出炉,以题为「Long-term follow-up of donor-derived CD7 CAR T-cell therapy in patients with T-cell acute lymphoblastic leukemia」的学术成果发表于 Journal of Hematology & Oncology(IF = 23.168),夯实了供者来源 CD7 CAR-T 在 r/r T-ALL 患者中的长期疗效与安全性。但对于不是重度治疗后失败的患者,自体 CD7 CAR-T 治疗是否有效和安全,尚待进一步研究。
然而与 B 系肿瘤患者不同,T 系肿瘤患者在自体 CAR-T 的应用中面临着更多的挑战和更高的要求。一方面,患者自身的 T 细胞发生癌变;另一方面,当前临床中大多数尝试 CAR-T 治疗的 T 系肿瘤患者往往处于末线治疗阶段。因此,从患者体内获取正常的健康 T 细胞、并获得有效的细胞制备量成为自体 CAR-T 细胞疗法应用于 T 系肿瘤的关键难点。
基于已有的研究成果与实践经验,潘静主任团队进一步探索了自体 CD7 CAR-T 在 r/r T-ALL/LBL 患者中的疗效与安全性,并在今年的 JSH 年会上通过国际学术舞台向世界共享学术成果、交流实践经验,进一步丰富了 CD7 CAR-T 在 T 系肿瘤中的应用证据,也为全球 T 系肿瘤患者带来了更多的治疗希望。
研究简介
一 研究方法
1. 自体 CAR-T 细胞制备
采用的载体与先前供者来源 CD7 CAR-T 细胞制品一致 (Pan J, et al. JHO, 2023& Pan J, et al. JCO, 2021)。在培养方面不同于其他研究,我们未采取提前 T 细胞筛选方法,大大降低培养难度,通过转导后的 CAR-T 细胞直接在培养物中杀伤肿瘤细胞的原理进行肿瘤清除,同时病人需要在三个检查点均培养物检测 MRD-后,保证产品无污染后回输。
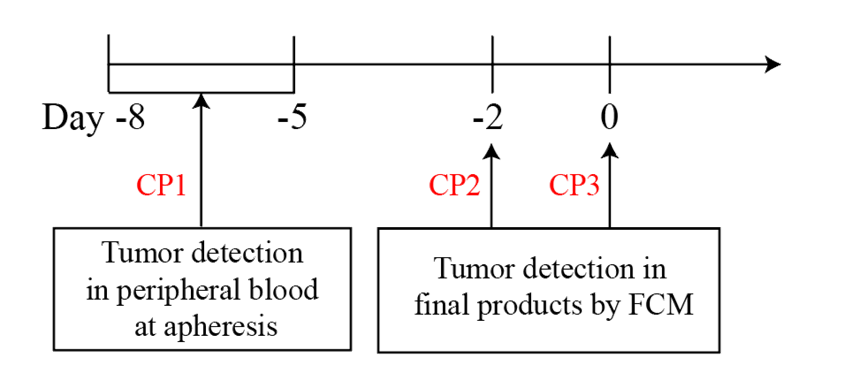
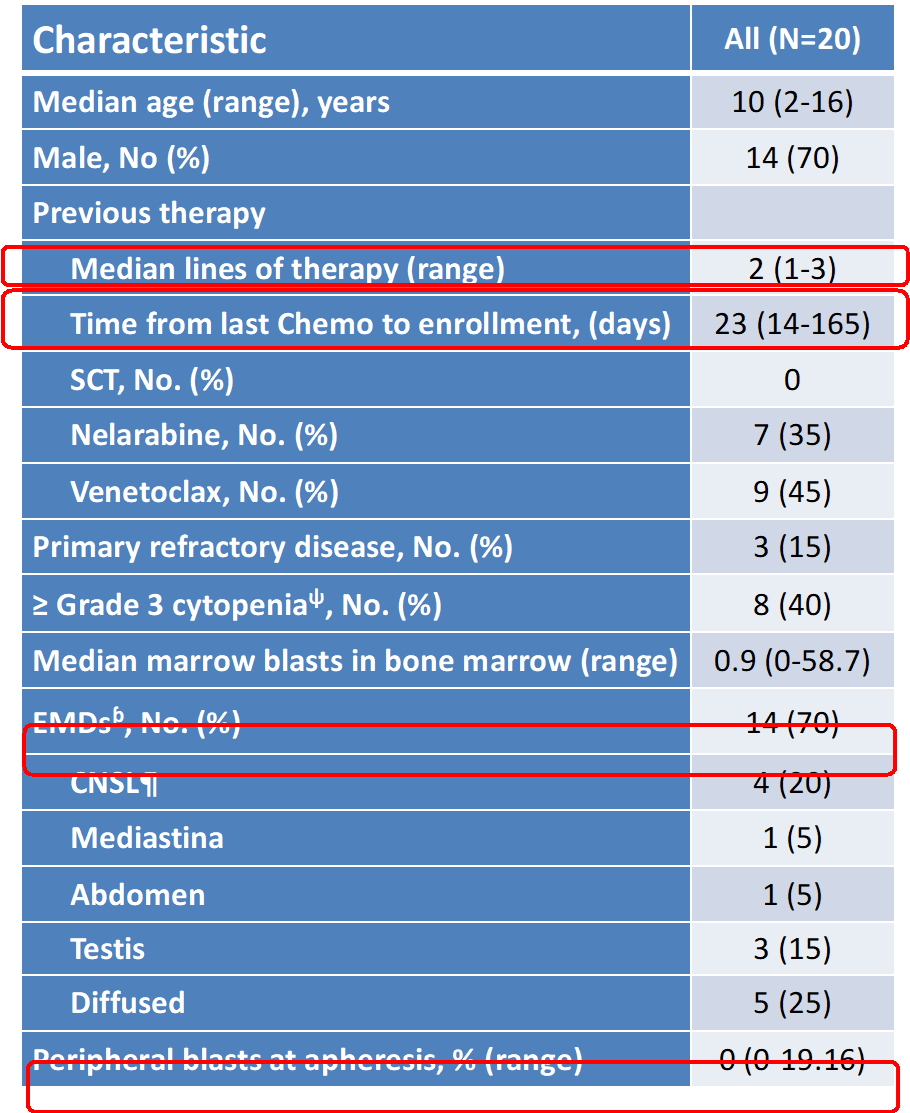
2. 患者基线特征
允许患者外周血为低肿瘤负荷(原始细胞<20%),入组患者的基线特征汇总统计如下:
二 研究结果
1. 安全性评估
观察到的短期不良事件(AE)中,一例患者出现剂量限制性毒性(DLT),伴随腹部肿块。最大耐受剂量(MTD)尚未确定。所有患者均未观察到 GVHD 或感染事件。
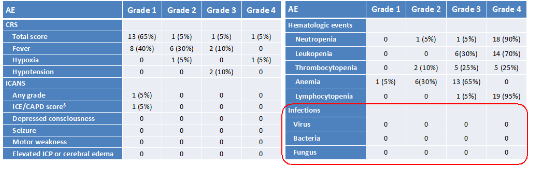
2. 疗效评估
截至 2023 年 9 月 21 日,在 CAR-T 输注 1 个月时,患者 MRD 阴性完全缓解(CR)率为 85%。
进行中位随访时间 9.2(范围 3.3-24)个月的随访显示,接受移植的 13 例患者中,9 例患者达到 MRD 阴性 CR;2 例复发;1 例出现进展;1 例发生移植相关败血症。
而在 7 例未接受进一步抗肿瘤治疗的患者中,3 例达到 MRD 阴性 CR;2 例复发;2 例出现进展。
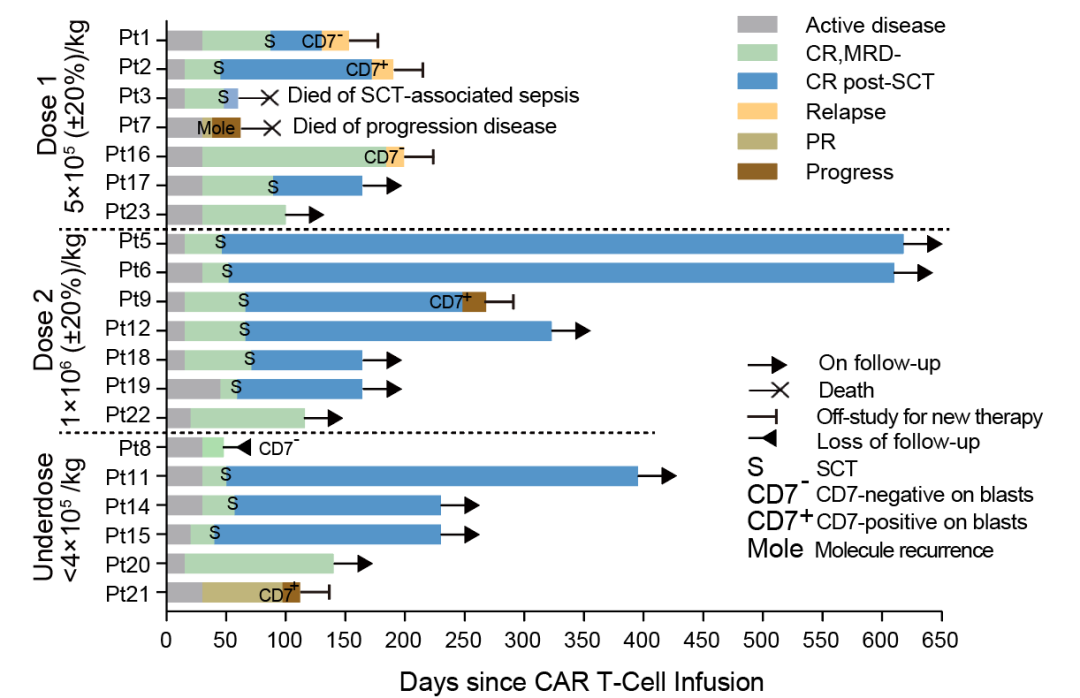
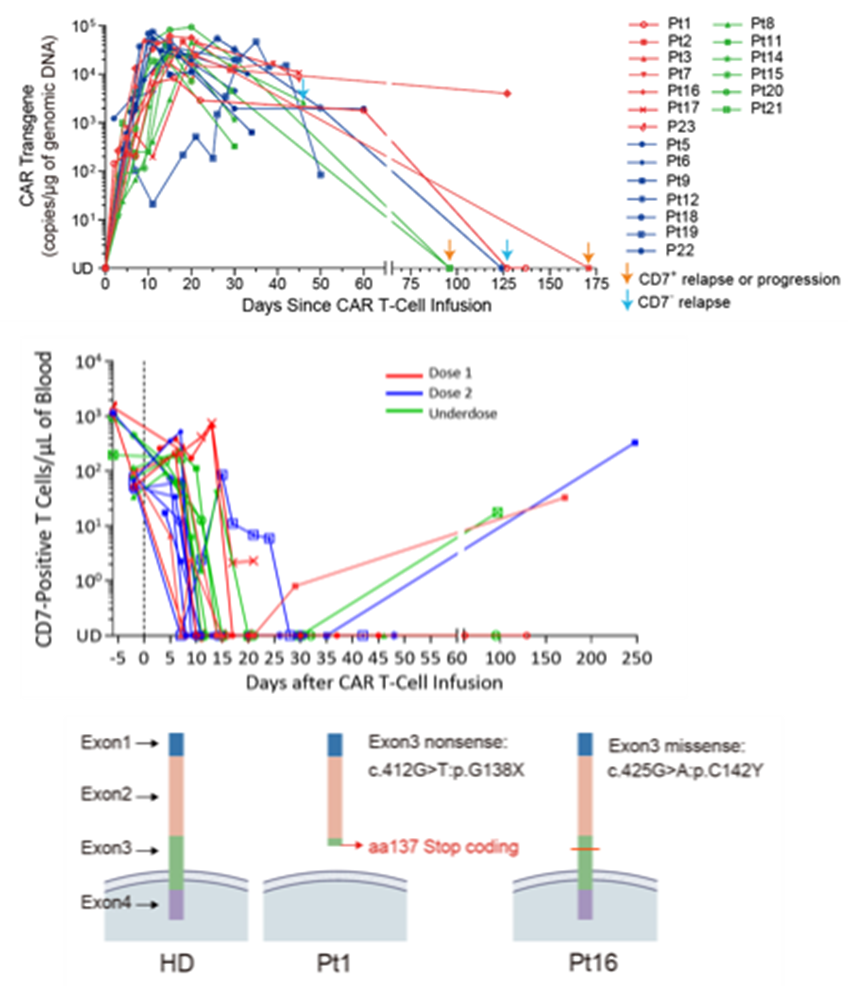
3.CAR-T 细胞输注后的扩增及疾病复发情况
进一步的流式分析显示,3 例患者(pt1、pt8、pt16)发生 CD7 阴性复发,其中包括 2 例 CD7 无义突变;1 例患者(pt2)CD7 阳性复发;3 例患者疾病进展(pt7 伴腹部肿块,Pt9 和 Pt 21 均转为 CD7 阳性 MRD 阳性)。
分析 CAR-T 细胞扩增情况后推测,观察到的 CD7 阳性复发可能与 CAR-T 细胞持续时间较短有关。
三 研究结论
自体 CD7 CAR-T 治疗 r/r T-ALL/LBL 是安全有效的。但培养难度远远高于供者来源的 CAR-T 产品,为了达到目标剂量,选择外周血肿瘤负荷较低(<20%), 同时合适的入组与采血时间是自体 CD7 CAR-T 细胞制备成功的重要因素。
与供体来源的 CAR-T 相比,自体 CAR-T 表现出更安全的特征,尤其在血液毒性和感染方面。对于肿瘤负荷低且能够从自身收集足够淋巴细胞用于 CAR - T 细胞制备的患者,优先推荐自体 CD7 CAR-T 细胞疗法。这就说明自体 CD7 CAR-T 细胞治疗更适合用于化疗线数不长的病人(2-3 线治疗失败),对于重度治疗后失败的病人,自体 CD7 CAR-T 治疗可能出现培养失败的情况,导致病人治疗无效。
结合本团队既往供者 CD7 CAR-T 细胞治疗 r/r T-ALL/LBL 的经验,自体和供者来源的 CD7 CAR-T 细胞治疗各有自己的适应人群,优势和不足之处,两者互为补充。为病人选择合适的治疗方案,抓住关键的治疗节点,才可能更好的提高患者的预后。
*注:文章图、表均源自潘静主任 2023JSH 年会汇报幻灯
专家介绍

好文章,需要你的鼓励