近日,西安交通大学第一附属医院麻醉学科带头人王强教授团队与帝国理工大学马大青教授共同在《British journal of anaesthesia》杂志(2023 IF: 9.8)发表题为「Reducing complement activation during sleep deprivation yields cognitive improvement by dexmedetomidine」的研究论著,该研究首次揭示了右美托咪定抑制补体 C3-C3aR 信号通路介导的小胶质细胞突触消除过程,阐明了右美托咪定改善睡眠剥夺相关认知功能障碍的新机制,为睡眠障碍相关性疾病的治疗提供了新策略。

睡眠不足已成为当今社会普遍存在的焦点问题。长期睡眠不足会导致各类疾病的患病率大幅增加,如心血管疾病、抑郁症、神经退行性疾病等。中国睡眠研究会《2022 年国民健康睡眠白皮书》调查数据显示,近 3/4 受访者曾有睡眠困扰,44% 的 19-25 岁青年存在长期熬夜的现象,42% 的老年人失眠率高达 21%。更重要的是,约 49% 的医务人员睡眠不足 6 小时。尽管有研究表明,睡眠不足会导致人对外界事物反应速度和感知能力的下降,但睡眠不足对许多更高级别认知能力的影响仍不清楚。右美托咪定 (dexmedetomidine, DEX) 是一种新型的高选择性、高特异性α2 肾上腺素受体激动剂,它作为一种仿生睡眠药物可诱导非快动眼睡眠 (NREM, non-rapid eye movement sleep) 出现,不对呼吸产生抑制,临床广泛应用于围术期及 ICU 患者的镇静。虽然有研究显示,右美托咪定可有效降低术后认知功能障碍发生率。但是该药物能否改善睡眠剥夺导致的认知功能障碍及具体机制仍不清楚。小胶质细胞作为大脑中主要的固有免疫细胞,其突触修剪和消除在神经发育和突触功能塑造过程中发挥重要作用。在病理状态下,补体 C3-C3aR 信号通路介导的小胶质细胞异常吞噬突触引起认知功能障碍。然而,右美托咪定是否通过调控补体介导的小胶质细胞突触消除过程从而改善睡眠剥夺认知功能障碍未见报道。针对上述科学问题,研究团队首先构建了慢性睡眠限制小鼠模型,发现慢性睡眠限制小鼠表现出学习记忆能力下降,而静脉注射右美托咪定可以改善慢性睡眠限制小鼠的认知功能障碍。脑电图结果分析表明,右美托咪定可显著延长慢性睡眠限制小鼠非快动眼 (NREM) 睡眠时长,增加 NREM 睡眠期 delta 波的占比。这充分说明,
右美托咪定不仅能够改善睡眠质量,还能改善睡眠剥夺所致的认知功能障碍。
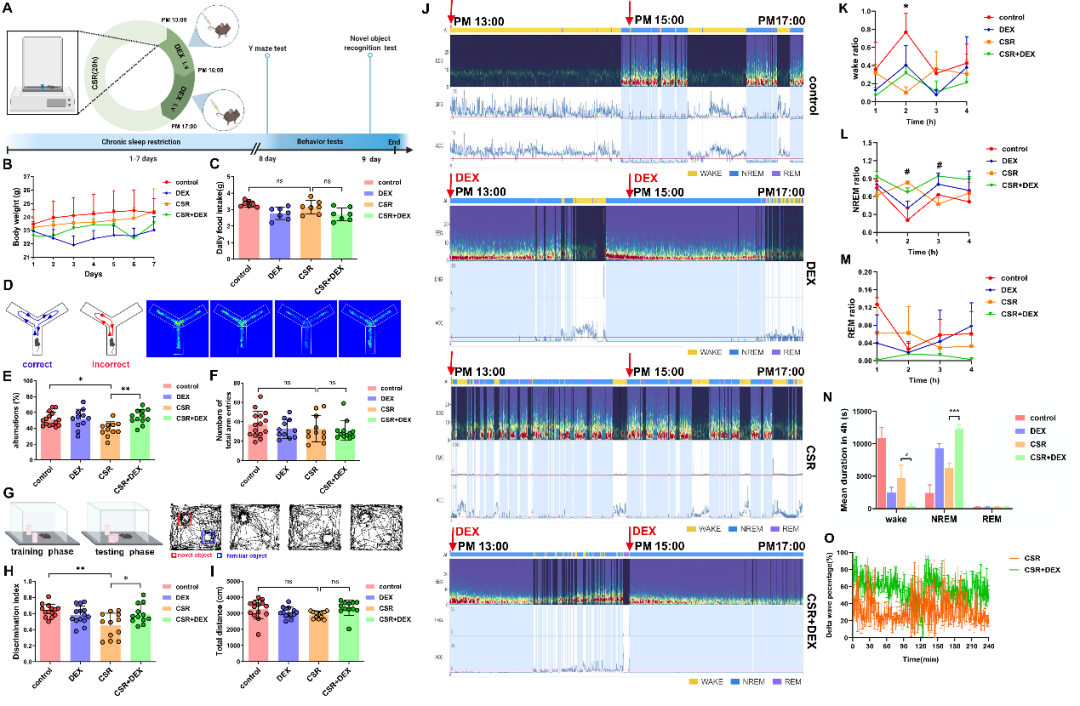
突触是记忆编码和储存的基础,突触数量和功能的改变可以影响认知功能。
为了进一步明确右美托咪定改善睡眠剥夺小鼠认知功能障碍的机制,研究人员提取了小鼠海马组织,发现慢性睡眠限制小鼠突触相关蛋白 PSD95 和 synaptophsin 的表达降低,而右美托咪定能够逆转 PSD95 和 synaptophsin 表达降低这一现象。高尔基染色结果同样证实,
右美托咪定能够逆转树突棘数量减少这一现象。
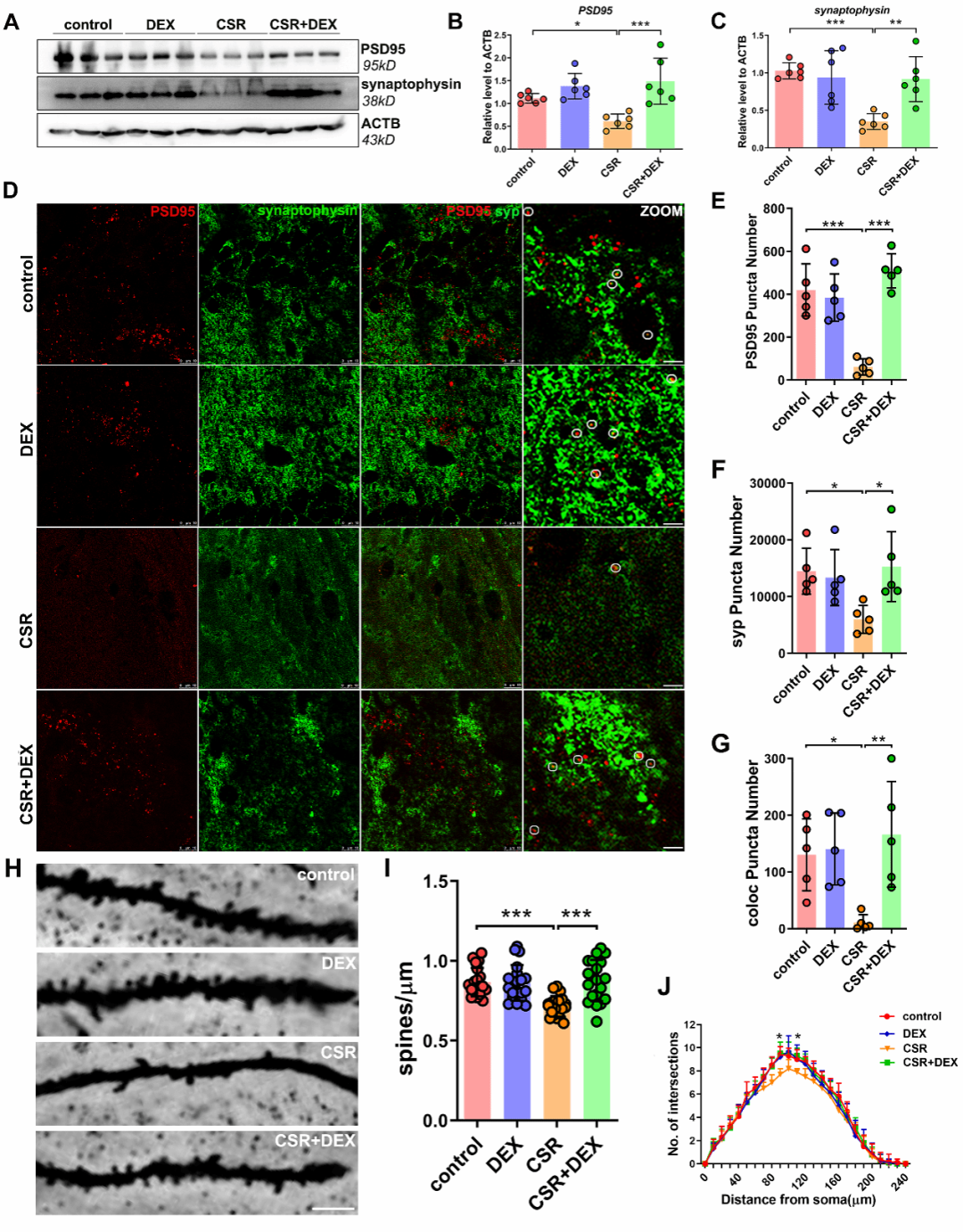
那么,由补体介导的小胶质细胞突触消除是不是引起突触变化的原因?研究人员发现睡眠剥夺后小胶质细胞激活,补体通路相关蛋白 C1q、C3、C3aR 的表达显著增加;而右美托咪定能够抑制小胶质细胞的激活和补体通路相关蛋白 C3、C3aR 的表达。这提示我们,补体介导的小胶质细胞突触消除可能参与右美托咪定改善睡眠剥夺相关认知功能障碍这一效应。
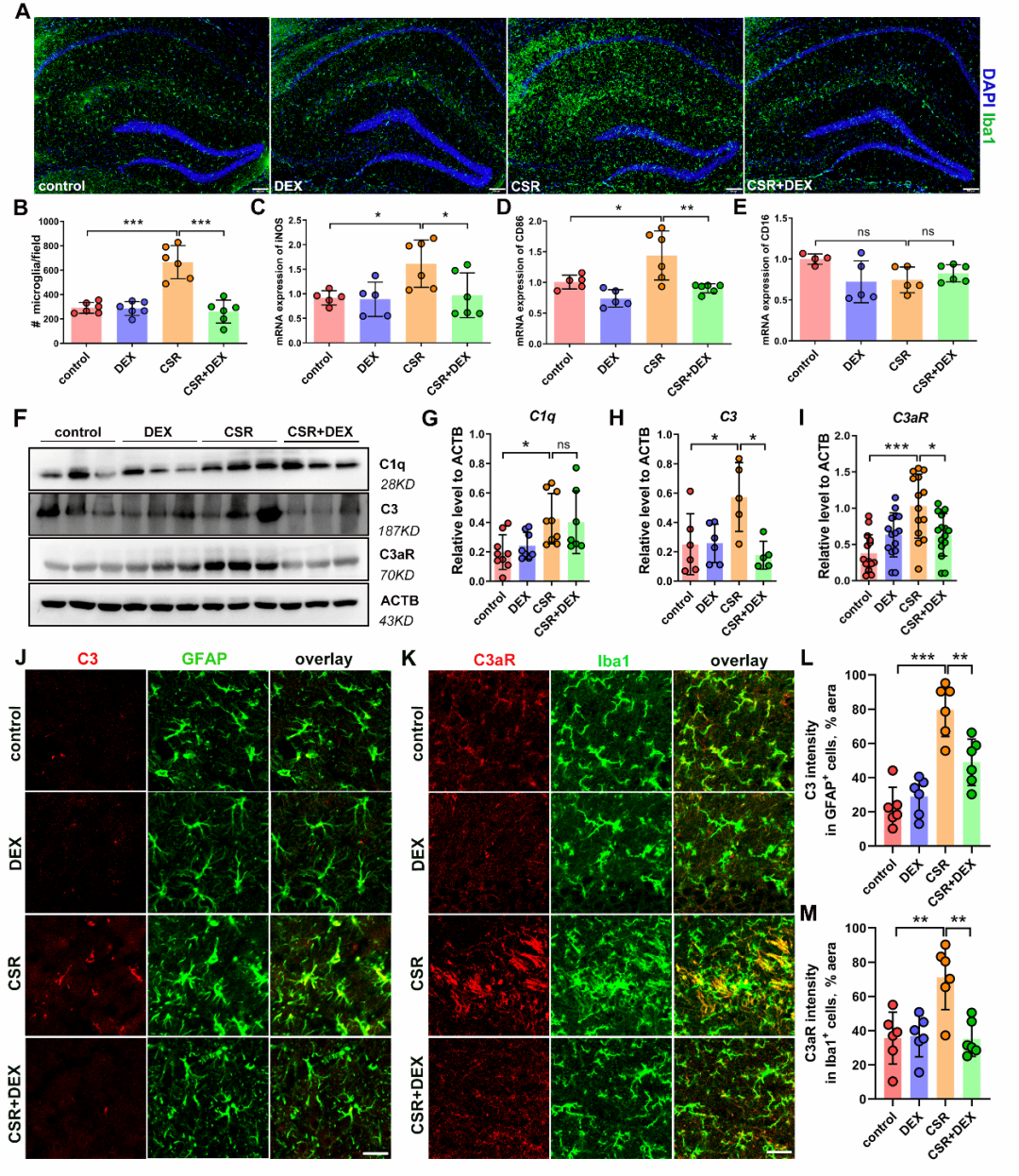
小胶质细胞往往通过吞噬突触发挥突触消除作用。于是,研究人员进一步观察了小胶质细胞吞噬功能的变化,发现慢性睡眠限制小鼠小胶质细胞吞噬突触增多、突触的丢失加剧,右美托咪定抑制小胶质细胞对突触的吞噬,进一步证实补体介导的小胶质细胞突触消除是导致睡眠剥夺后认知功能下降的重要原因,右美托咪定抑制突触消除过程从而改善认知功能障碍。
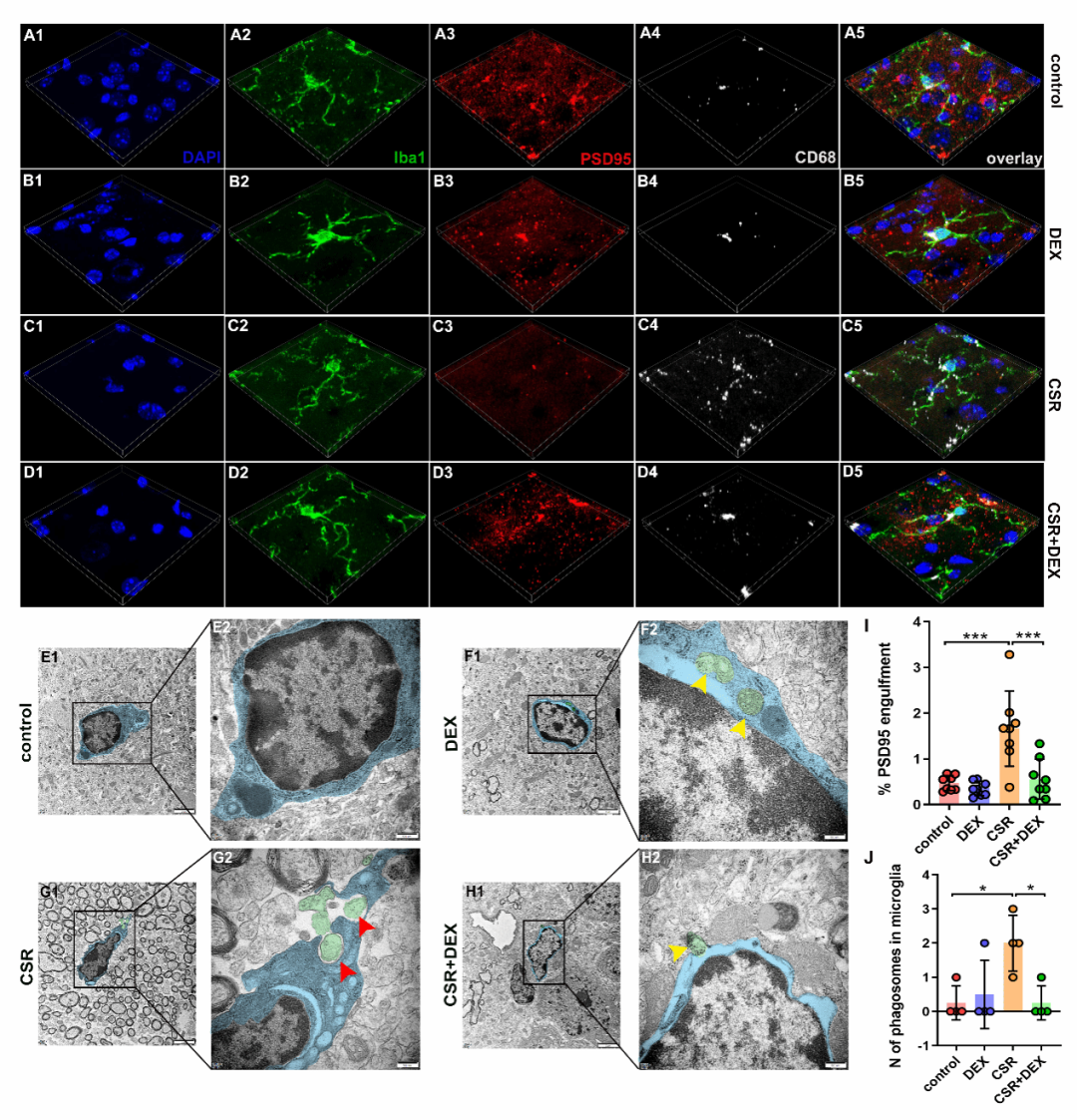
虽然已证实右美托咪定能够抑制补体信号的激活,但阻断 C3-C3aR 信号后右美托咪定对小鼠认知功能、突触数量的影响是否发生变化?研究人员给予 C3aR 抑制剂 SB290157 发现阻断 C3-C3aR 信号同样可以逆转慢性睡眠限制小鼠认知功能下降以及突触缺失这一现象,且与右美托咪定本身的作用无差异。
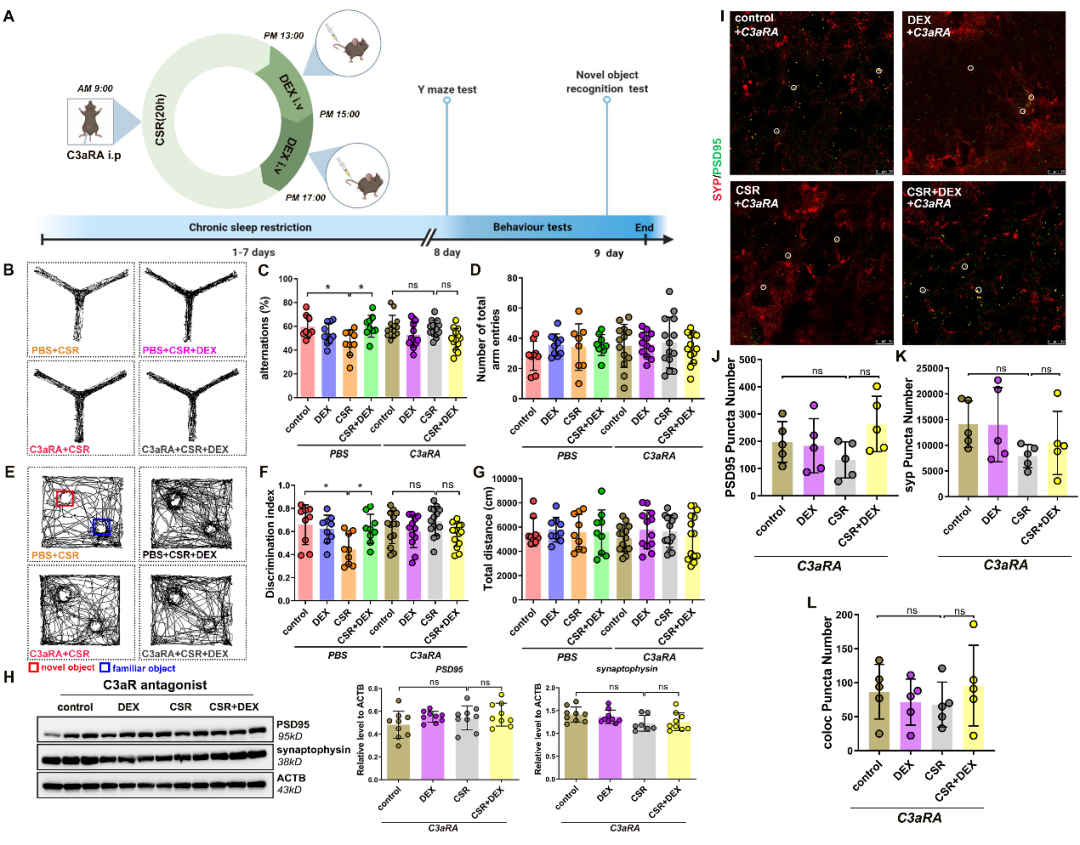
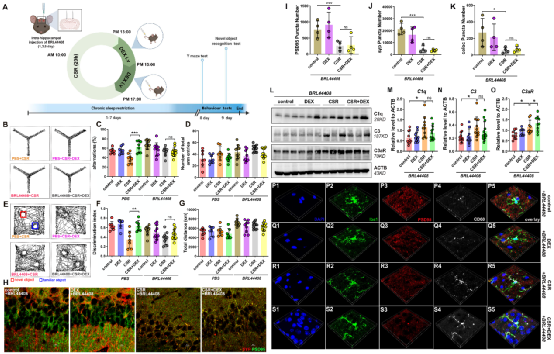
最后,右美托咪定抑制补体介导的突触消除过程是否通过激活脑内 a2 肾上腺素受体?α2 肾上腺素受体主要分为α2A、α2B、α2C 三种亚型,其中α2A 和α2C 受体主要分布在中枢神经系统。已有研究报道,在小鼠海马组织中主要以α2A 受体表达为主,且仅表达在星形胶质细胞表面。研究人员通过脑立体定位注射 a2A 肾上腺素受体抑制剂 BRL-44408,发现右美托咪定改善认知功能、抑制补体蛋白 C3 与 C3aR 的表达、抑制小胶质细胞对突触的吞噬作用均被 BRL-44408 阻断,说明
右美托咪定通过激活星形胶质细胞 α2A 受体抑制补体 C3-C3aR 通路从而发挥改善睡眠剥夺认知功能障碍的作用。
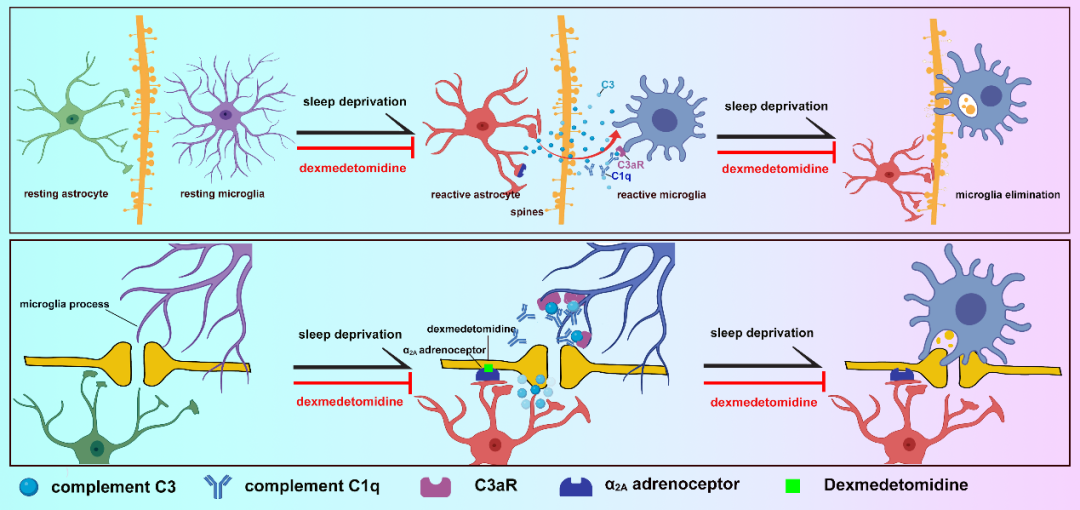
综上所述,该研究首次揭示右美托咪定激活星形胶质细胞 α2A 受体抑制其释放补体 C3,C3 作用于小胶质细胞 C3aR 抑制其对突触的吞噬,减少了睡眠剥夺后的突触缺失,从而改善睡眠剥夺认知功能障碍。该研究为理解右美托咪定改善认知障碍提供了新的机制见解。
以上研究说明,右美托咪定既能提高睡眠质量也能发挥改善认知功能障碍的「双重」作用,未来可能可以成为治疗失眠的首选药物,为失眠患者带来福音。
西安交通大学第一附属医院助理研究员翟茜博士为本文的第一作者,王强教授与马大青教授为论文通讯作者。西安交通大学第一附属医院为第一完成单位。本研究得到了国家自然科学基金(81901237,81774113, 81974540)与中央高校基本科研业务费(xzy012022110)的资助。
好文章,需要你的鼓励















