近年来,嵌合抗原受体 T(CAR-T)细胞疗法作为治疗癌症最有效的方法之一,在淋巴瘤的治疗中表现出十分满意的疗效,而自体造血干细胞移植(ASCT)亦是治疗淋巴瘤非常重要的手段。淋巴瘤患者什么时候选择 CAR-T?什么时候选择自体移植?两种治疗手段如何巧妙联合,为患者带来更多治疗的希望?本文中,北京高博博仁医院成人淋巴瘤/骨髓瘤专家胡凯主任以「CAR-T 与自体移植的巅峰较量——选择时机?可否联合?」为题,为大家详细讲解了 CAR-T 与自体移植在淋巴瘤治疗中的进展与应用。

传统 ASCT 的治疗选择时机及治疗疗效
ASCT 可作为高危一线巩固治疗及复发/难治二线有效治疗后的巩固治疗,但对化疗不敏感的患者 ASCT 疗效不佳。
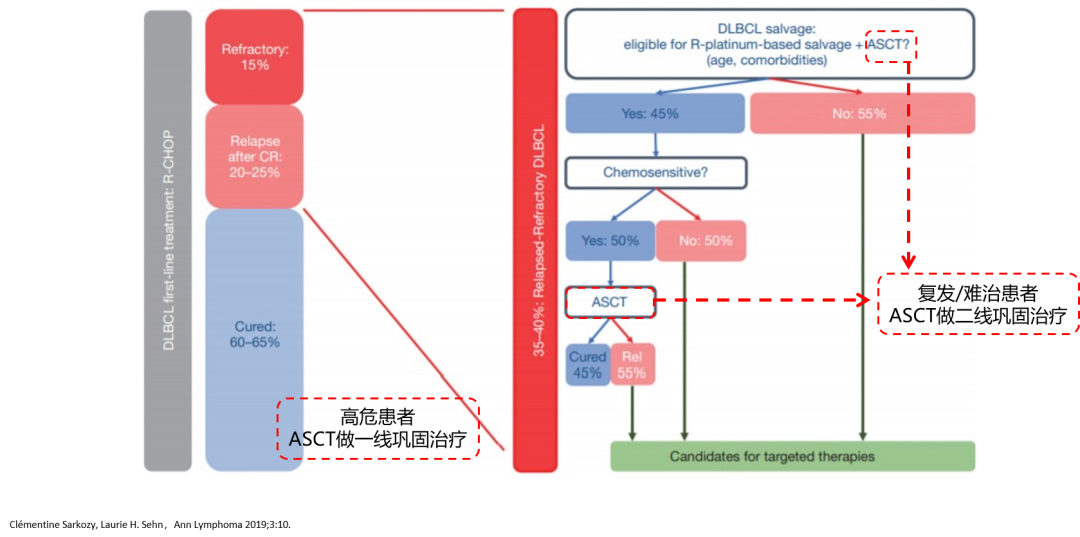
ASCT 作为高危患者一线巩固治疗,是否提高了生存?
首先,什么是「高危因素」?
- 肿瘤负荷高?IPI 指数中-高危、多发结外病灶、结外大包块>7 cm、中枢及骨髓侵犯。
- 患者体能及一般状况?ECOG 评分、合并症指数。
- 病理及遗传学高危因素?高级别、FISH(MYC、TP53 断裂)。
- 分子高危因素?TP53 突变、分子高级别。
- 治疗敏感性差?中期 PET-CT(第 2 及第 4 个疗程)评估未达到客观缓解率(ORR)。
(1)将 IPI 评分作为高危因素,ASCT 一线巩固提高了 IPI 高危患者的生存。
一项随机对照研究显示,当未区分 IPI 评分时,化疗和 ASCT 组的生存率差异不大【2 年无进展生存(PFS)率:69%vs55%;2 年总生存(OS)率:74%vs71%】。但 IPI 高危组中,ASCT 组的生存率明显高于化疗组(PFS 率:75%vs41%;2 年 OS 率:82%vs64%)。可见,ASCT 一线巩固提高了 IPI 高危患者的生存。
(2)将中期 PET-CT 疗效评估作为高危因素,ASCT 一线巩固提高了生存。
一项研究基于中期 PET-CT 疗效评估,探索了弥漫大 B 细胞淋巴瘤(DLBCL)患者 ASCT 一线巩固治疗的效果。对于第 2 疗程 PET 无效、第 4 疗程有效者,缓解后行 ASCT 作为巩固治疗。研究结果显示,第 2 疗程及 4 疗程 PET 均有效者,2 年 PFS 率 89.9%,OS 率 94.8%。第 2 疗程 PET 无效、第 4 疗程有效者,ASCT 后生存率明显提高,2 年 PFS 率 89.9%,OS 率 92.8%。可见,ASCT 巩固治疗提高了该组患者的生存。所以,疗效评估对于临床后续的治疗以及整体治疗策略的制定是非常重要的。
复发/难治的患者,对于化疗敏感,ASCT 二线巩固可提高患者的生存
复发/难治患者对于化疗敏感,后续做 ACST 二线巩固是否能提升患者生存呢?一项研究纳入了 215 例复发难治 B 细胞非霍奇金淋巴瘤(B-NHL)患者,将高剂量化疗后有效的患者分成化疗/放疗组(N = 54)和 ASCT(N = 55)组,评估了化疗/放疗与 ASCT 二线巩固对患者生存的影响。研究结果显示,ASCT 和化疗/放疗的有效率为:84%vs44%,5 年无事件生存(EFS)率:46%vs12%,5 年 OS 率:53%vs32%。可见,移植大概提高了 20% 的长期生存率。
但是,有些复发/难治患者虽然对二线化疗敏感,也可能对 ASCT 效果不佳。ASCT 治疗预后不佳的因素有:① 诊断后 12 个月内复发;② aa-IPI(年龄调整的 IPI 评分)大于 1 分;③ 在 ASCT 时 PET-CT 显示未能获得比部分缓解(PR)更好的治疗。此外,难治/复发 DLBCL 患者,能够接受 ASCT 的比例低。HD-ASCT 属于强效疗法,部分患者可能无法耐受此治疗;对于符合条件的复发或初始治疗无效的患者,挽救化疗序贯高剂量自体干细胞移植(HD-ASCT)是标准治疗,二线患者取得治愈的可能性仅约 10%。
小结
ASCT 是否需要作为「高危患者」一线巩固治疗,目前尚有争议,需要明确界定「高危因素」是哪些。中国的患者就诊期较晚、复发/难治后能选择的新药较少,对于「高危患者」,建议一线 ASCT 巩固治疗。ASCT 作为复发后再次缓解的二线巩固治疗,对于化疗敏感的患者疗效确定,但有条件选择 ASCT 的患者有限;化疗不敏感的患者疗效差。
CAR-T 治疗时代,CAR-T 能否用疗效来挑战 ASCT 地位?
CAR-T 细胞治疗的出现是淋巴瘤治疗的里程碑事件,它在淋巴瘤治疗体系中发挥了重大的作用,尤其是 B 细胞淋巴瘤的治疗效果再上一个台阶。那相较于自体移植,CAR-T 的效果如何呢?
关注难治/复发患者,CAR-T vs ASCT 疗效如何?
国外一项研究(ZUMA7 研究)对比了 CAR-T 与 ASCT 作为难治/复发患者二线治疗的疗效与安全性。研究结果显示,CAR-T 组的无事件及无进展生存率(mEFS 及 PFS)是 ASCT 组的 4 倍。CAR-T 对比 ASCT 作为难治/复发二线治疗有生存优势,年龄 ≥ 65 岁者以及肿瘤负荷高的患者 CAR-T 组 EFS 均较 ASCT 组明显延长,且 CAR-T 治疗未增加不良反应。原发耐药或 1 年内复发 DLBCL 患者,CAR-T 作为二线治疗对比 ASCT 有明显优势。
高危一线巩固,CAR-T 是否有意义?
既然 CAR-T 治疗复发难治患者的疗效优于移植,那有没有可能用于一线治疗呢?ZUMA 12 研究对此进行了探索。该研究采用 CAR-T 治疗一线高危大 B 细胞淋巴瘤,研究结果显示,CAR-T 作为高危患者一线治疗的 ORR 为 89%,完全缓解(CR)率为 78%;12 个月的 PFS 率 81%,EFS 率 3%,持续缓解(DOR)率 75%,OS 率 91%,而且安全性可控。
小结
CAR-T vs ASCT 作为二线治疗,有明显生存及疗效优势,副反应可控,尤其对原发耐药及诊断后一年内复发的患者;CAR-T vs ASCT 作为一线巩固,缓解率高,安全性可控,生存值得期待。
当 CAR-T 与 ASCT 相遇,会擦出怎样的火花?
CAR-T 联合 ASCT 治疗的模式有协同作用的理论依据。淋巴瘤具有介于白血病和实体瘤之间的特征,肿瘤免疫抑制微环境(TME)会限制 CAR-T 功能,而输注 CAR-T 细胞之前强的预处理清淋方案能破坏 TME,更有效增强 CAR-T 细胞的功能和增殖。首先,ASCT 的强预处理方案后,免疫抑制性 TME 会减少,肿瘤负荷明显下降;其次,在造血重建期间给予 CAR-T 细胞治疗,可以根除移植后的残余疾病,从而降低复发率。
国内外多项研究表明,CAR-T 联合 ASCT 治疗的模式可以进一步提高抗肿瘤活性并降低复发率。
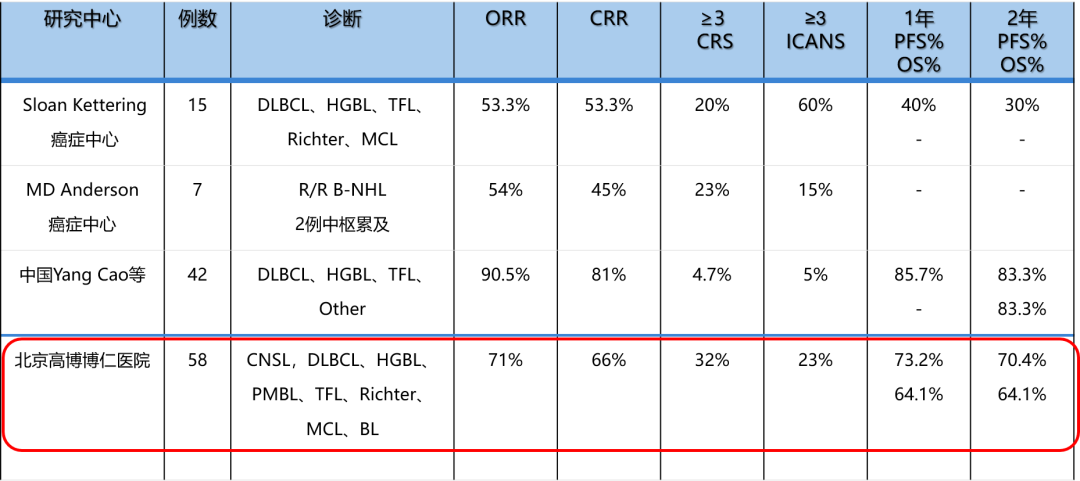
小结
CAR-T 与 ACST 具有协同作用,对于特定患者可进一步加深缓解程度,延长生存期,且安全性可控;CAR-T 联合 ASCT 治疗的模式可以进一步提高抗肿瘤活性并降低复发率。
治疗方案的选择及病例分享
治疗纷繁复杂,如何为患者选择治疗方案呢?
首先,治疗前针对疾病进行充分沟通,了解目前的疾病状态,制定完整细致的全套治疗方案。其次,在治疗过程中充分沟通,争取患者及家属最大程度的配合。最后,建立完整的病情评估体系及流程,并根据病情调整治疗方案,治疗后进行密切的随访。
病例一,男性,55 岁,DLBCL,非生发中心亚型
入北京高博博仁医院治疗前:
- PET-CT:病灶累及纵膈、腹腔、甲状腺、肝胃间隙、心包、胃、腹膜、肠管等。
- 心脏超声提示心包积液(大量);冠脉 CTA 提示:肺栓塞,右心底软组织肿块累及右心房、右心室。
- 外院 R-CDOP×5 达到 PR;PD-1+ICE,疾病进展(PD)(左顶叶皮层下淋巴瘤合并出血及脑水肿);RCEPP×2 疾病进展。
2021 年 3 月我院接诊,诊断:弥漫大 B 细胞淋巴瘤(IVA 期)。
- PET-CT:胸膜、双肺、心脏肿物、盆腔小肠、多发肌肉占位,淋巴瘤多发浸润。
- 超声穿刺活检(左下肢新发),DLBCL,non-GCB;免疫组化:CD19(++)。
- 血液肿瘤相关基因突变筛查检测:ARIDlA、BTG2、PIM1、AIM1、ALK、BT、TG2、CCND3、CD58、CD79B、DUSP2、HISTIHIE、KMT2D、MYD88、NPM1。
- 心脏超声:右房室多个中等偏低回声团块,横跨三尖瓣,与右房、室壁粘连,7.3×4.4 cm。
针对该患者,我们临床采用来那度胺+BTK 抑制剂+Pola-BR 减瘤策略,后进行人源化 CD19 CAR-T 治疗。之后采集自体干细胞,行 ASCT+人源化 CD22 CAR-T 治疗,患者最终达到无病生存。
病例二,女性,31 岁,原发纵膈大 B 细胞淋巴瘤
入北京高博博仁医院治疗前:
- 免疫表型:异型淋巴细胞 Bc1-2(+80%),Bcl-6(+),CD10(-),CD19(+),CD20(+),CD22(+),CD23(+),CD30(+),CMVC(+30%),EBER(-),K167(+90%),MUM-1(+)。
- 外院采用 R-DA-EPOCH×4、GVD+PD1 单抗×2 治疗,疾病进展(头颅核磁发现小脑占位),高剂量 MTX+GVD+PD-1 单抗+鞘注仍然进展。
2019 年 9 月我院接诊,诊断:原发纵膈大 B 细胞淋巴瘤。
- 胸部 CT:左前纵隔内见肿块影,4.7×7.6×8.9 cm,右侧腋窝淋巴结肿大。
- 头颅核磁:小脑异常信号。
临床给予减瘤方案×3 次+自体外周血造血干细胞采集,自体造血干细胞移植(预处理 BEAM 方案)+鼠源 CD19 CAR-T 治疗,并联合纵膈局部放疗、PD1 单抗治疗,后给予人源化 CD20 CAR-T 治疗,PD1 单抗治疗。2020 年 9 月 PET-CT 评估显示 CR,目前无病生存。
病例三,男性,21 岁,Burkitt 淋巴瘤
入北京高博博仁医院治疗前:
- 就诊于外院普外科,诊断为「肠套叠」,手术:肿瘤直径约 2.5 cm,侵及肠壁全层,回盲瓣、阑尾;结肠周围淋巴结可见肿瘤累及;
- FISH 结果提示该标本存在 C-MYC 基因断裂重组。外院给予 Hyper-CVAD-A 方案及 Hyper-CVAD-B 方案,疾病复发。
2019 年 1 月我院接诊,诊断:伯基特淋巴瘤 IVA 期。2019 年 10 月超声引导下穿刺活检术病理回报提示(左腹部),Burkitt 淋巴瘤。
- 免疫组化:CD20(+,95% 强),CD19(+,95% 强),CD22(+,95% 强),CD38(+,95% 强),CD10(+),C-myc(85%+)TdT(-),P53(95%,强弱不一,野生型)PD-1(-),PD-L1(背景细胞+),BCL2(-),BCL6(+),Ki-67(95%+),原位杂交结果:EBV-EBER(-)。
- 血液肿瘤相关基因突变筛查检测:TP53、ID3、GNA13、TPMT 变异。
临床给予减瘤方案×2+鞘注 2 次,后行鼠源 CD19 CAR-T 治疗,采集自体外周血造血干细胞,自体造血干细胞移植(预处理 BEAM 方案)+人源化 CD22 CAR-T 治疗,后行人源化 CD20 CAR-T 巩固,2020 年 9 月 PET-CT 评估显示无活性代谢灶。
结语
针对复发/难治弥漫大 B 细胞淋巴瘤(R/R DLBCL),减瘤化疗过程中应根据患者情况及治疗效果适时采集造血干细胞。减瘤后有些患者能够达到完全缓解(CR):如果是二线化疗达到 CR,后续可以做自体移植,按传统方法治疗;如果是 ≥ 三线化疗才达到 CR 的患者,单纯做自体移植往往不够,建议做自体移植联合 CAR-T 治疗。
还有一些患者减瘤治疗没有达到 CR,这部分患者分为两类:一类是部分缓解(PR),一类是疾病稳定/进展(SD/PD)。针对 PR 患者,建议先做 CAR-T 进一步降低肿瘤负荷,达到 CR 后再做自体移植联合 CAR-T 治疗;针对 SD/PD 患者,不建议继续化疗,可以尝试免疫治疗。即便免疫治疗只能达到部分缓解,至少能为患者争取到休养生息的时间,可能改善患者整体的状态,后续再尝试其他的治疗方案。
总的来说,R/R DLBCL 的治疗策略强调个体化和精准化治疗,治疗的每一步都要认真思考、反复斟酌与密切观察。
好文章,需要你的鼓励