AJH 前沿——陆道培医学团队:新型 CD19 靶向合成 T 细胞受体和抗原受体 (STAR)-T 细胞治疗 R/R B-ALL
2022 年 5 月 1 日,陆道培医院陆佩华教授团队和清华大学医学院林欣教授团队合作在美国著名血液学杂志 American Journal of Hematology (IF = 10.047) 发表新型 CD19 靶向 STAR-T 细胞治疗 R/R B-ALL 的研究论文,该项研究的临床前研究以及临床研究用 STAR-T 和 STAR-OX40-T 细胞均由清华大学(医学院)和华夏英泰生物科技公司研发和制备。首次人体 I 期临床研究在陆道培医院进行。

研究背景
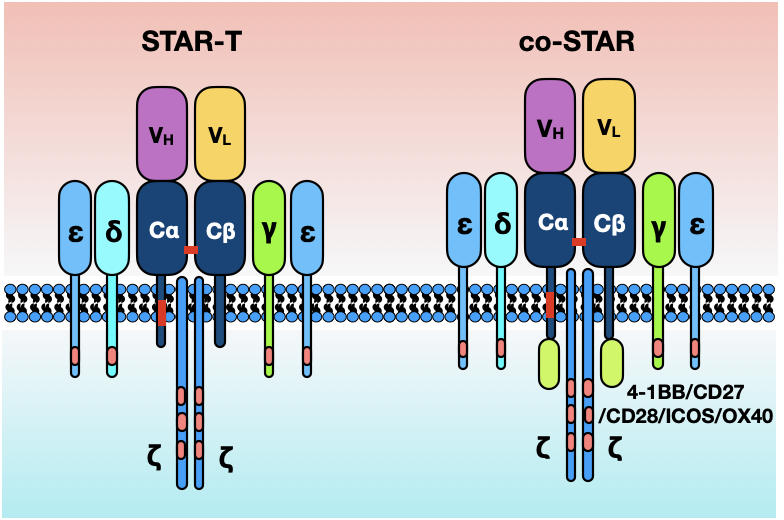
CAR-T 细胞疗法在 B 细胞恶性肿瘤患者中已显示出高应答率,但缓解持续时间和安全性仍待提高。研究者开发了一种新型的双链嵌合受体——STAR,由 2 个蛋白质模块组成,每个模块均包含抗体轻链或重链可变区,融合的 T 细胞受体(TCR)a 和 b 链恒定区与 OX40 共刺激域结合,通过自裂解弗林蛋白酶-p2A 序列连接的 2 个模块,允许模块通过蛋白水解分离和重组。本文报告了 STAR-T 细胞疗法的临床前研究和 CD19 STAR-OX40-T 细胞治疗难治/复发(R/R)急性 B 细胞淋巴细胞白血病(B-ALL)的 I 期临床研究结果(https://clinicaltrials.gov,NCT03953599)。
研究方法
从健康供体和患者分别获得外周血(PB)单核细胞,用于临床前和临床研究;应用慢病毒载体把 STAR 结构转导至 T 细胞获得 STAR-T 细胞,并利用白血病异种移植小鼠模型评估 STAR-T 细胞抗肿瘤功能。从 2019 年 12 月至 2020 年 6 月,该试验共入组 18 例 CD19+ R/R B-ALL 患者(男女比例为 10:8),中位年龄为 22.5 岁。在输注 STAR-OX40-T 细胞前,患者接受 3 日的静脉注射氟达拉滨(25 mg/m2·d)和环磷酰胺(250 mg/m2·d)的预处理治疗。在患者达到完全缓解(CR)后,可以选择是否继续进行巩固性的异体造血干细胞移植(allo-HSCT)。
研究结果
- 临床前研究结果
在临床前细胞水平研究中发现 CD19 STAR-T 细胞在靶细胞的刺激下,其展示出更快的活化时间,更高的细胞因子分泌量以及更好的肿瘤杀伤效果,显著优于常规 CAR-T 细胞(BBz-CAR),在白血病异种移植小鼠模型中,在不同剂量的 T 细胞治疗下,STAR-T 细胞比 BBz-CAR-T 细胞展示出更强的肿瘤清除,并无显著的组织损伤情况;随后,进一步偶联不同共刺激分子至 STAR 结构进行优化以增强 STAR-T 细胞的增殖能力,细胞水平结果显示 STAR 偶联 OX40(STAR-OX40) 后,在靶细胞的刺激下能显著增加 IL-2 的分泌以及增殖水平,该结构显著优于其他结构 (如:STAR-4-1BB,STAR-CD28,STAR-CD27,STAR-ICOS),此外,其在靶细胞与外周血细胞共培养体系下,分泌出更低的细胞因子风暴(CRS)相关的细胞因子。不同的白血病异种移植小鼠模型结果同样显示 STAR-OX40-T 细胞具有更好的肿瘤清除效果和增殖效果,并且能够有效的抑制肿瘤的复发效果。根据细胞水平和动物水平的研究,STAR-OX40 结构用于 I 期临床研究。
- 临床研究结果
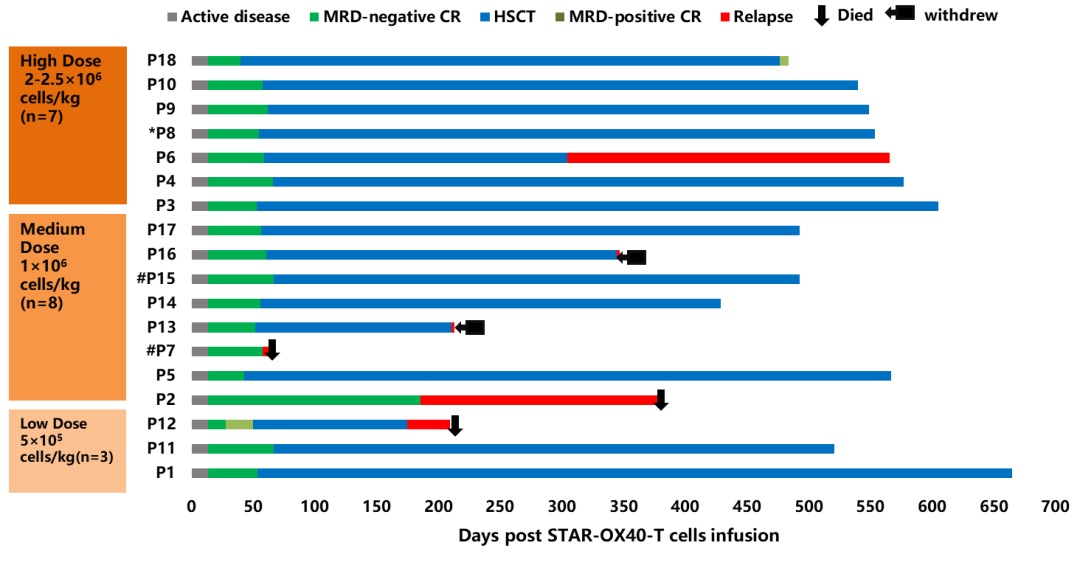
该 I 期临床试验中,中位随访时间为 507 天 (范围:63-665 天)。治疗前中位骨髓原始细胞水平为 15.3%(范围 0.5%- 90.5%),1 例为移植后复发患者,2 例有中枢神经系统白血病 (CNSL)。18 例患者均接受中位剂量为 1×106/ kg 的 STAR-OX40-T 细胞的单次输注:低剂量组(5×105/ kg,n = 3),中剂量组(1×106/ kg,n = 8)和高剂量组(2~2.5×106/ kg,n = 7)。从采集到输注 STAR-OX40-T 细胞的中位时间为 9 天(7-13 天)。
中位转染效率为 57.4%。STAR-OX40-T 细胞输注后两周评估,100%(n = 18)的患者获得完全缓解(CR)且微小残留病(MRD)阴性,在 30 天后评估,CR 率为 100%,有 1 例患者出现了原始细胞 0.09% 的 MRD 阳性。在 STAR-OX40-T 细胞回输后中位 57.5 天(范围:40-67 天),16/18(88.9%) 的 CR 患者(15 例 MRD 阴性,1 例 MRD 阳性)选择接受了巩固性的 allo-HSCT。在中位随访 549 天(范围:433-665 天)后,11 例患者仍保持 MRD 阴性 CR,1 例在第 477 天变为 MRD 阳性,其他三例分别在第 211 天、第 305 天和第 345 天出现复发,1 例在第 210 天死亡。
在 allo-HSCT 后,7 例患者出现急性 GVHD(4 例 I 级、1 例 II 级、1 例 III 级和 1 例 IV 级),3 例患者出现局限于皮肤或肺部的轻度慢性 GVHD。在未接受巩固 allo-HSCT 的两例患者中,一例在第 58 天复发并在第 63 天死亡。该患者的治疗前 BM 原始细胞水平比例为 90%,BCR-ABL1(P210) 阳性且患有 CNSL。另一例在第 186 天复发,并在第 378 天死于复发。整体来看,总共有 6 例患者在接受 STAR-OX40-T 细胞治疗后复发。出现复发时,4 例患者为 CD19+,2 例患者为 CD19-。
关于不良反应方面,只有 55.6%(n = 10)的患者出现了 1-2 级轻度的细胞因子释放综合征 CRS,其中 8 例患者为 1 级 CRS,2 例为 2 级 CRS。另外,2 例患者出现 3 级神经毒性反应。
输注 STAR-T 细胞后,通过 qPCR 和流式监测外周血中的 CD19 STAR-OX40-T 细胞。无论输注剂量如何,STAR-OX40-T 细胞都显示出高的体内细胞扩增和持久性。qPCR 显示达到峰值水平的中位时间为 8.5 天 (范围:4-10 天),中位扩增倍数为 4.9×104copies/μ外周血基因组 DNA。流式结果显示中位 STAR-OX40-T/CD3 峰值为 13.87%(范围:1.42%-88.1%),而且有患者在输注 6 个月后依然能检测到 STAR-OX40-T 细胞水平。
研究结论
此临床前研究证明了 STAR-T 细胞在临床前研究及动物模型中在 T 细胞活化能力、细胞因子产生能力和抗肿瘤疗效方面比常规 CAR-T 细胞优越。首次用在人身上的 I 期临床研究证明了 STAR-OX40-T 在治疗 CD19+ R/R B-ALL 中的技术可行性、临床安全性和有效性。输注后可达到较高的 CR 率,且毒性较低。但仍需对这些患者进行长期观察,并进行更大范围的患者研究。
好文章,需要你的鼓励