编者注:作者阳思明语是丁香园临床试验版版主,有丰富临床试验实践经历。他有一个自己的公众号「阳思明语」,记录这个行业的发展情况和自己的一些看法和。因此,我们请...
编者注:作者阳思明语是丁香园临床试验版版主,有丰富临床试验实践经历。
他有一个自己的公众号「阳思明语」,记录这个行业的发展情况和自己的一些看法和。
因此,我们请他来丁香园做一个专栏。
我们希望能给中国医学生和医生一种新的眼界,不做医生能做什么?
以及如果想去药企 or 外企,应该有什么样的职场专业态度。
两位新职员的故事
先讲两个人吧。
A,一位女生,毕业做 CRC(Clinical research coordinator, 临床研究协调员)一年,来自某 SMO(Site Management Organization,临床试验协调运筹中心)。
由于广州实在没有人手,被我们借过来临时救火,充当 CRA(Clinical Research Associate,临床监查员)的工作。我交给她一项任务,给某家中心的机构上传文件,完成机构立项通过后排队上伦理。交代完后,上午她动不动刷手机,下午我咨询她进展,她说,文件太大,传不上去。
我问:「你上网搜索过软件,如何压缩文件大小吗?」
「没有。」
我问:「你有没有在传不上去第一时间找我反映,请教?」
她沉默不语。
下午上班后,她果然改进很大,跑来问我文件怎么安装、破解码怎么获取……我耐心讲解,安装。
第二天,问题仍然没有解决,我让她帮忙去打印社或图片社问问,我们公司出钱,能否帮忙解决这个问题?
说完我匆匆埋进电脑,处理很多家中心递交伦理资料和机构立项资料的文件大海中。
她闷头不语,出去了。
说实话,我当时居然操心的想,她会不会没有带 U 盘?她准备怎么找图片处理社呢?她会坚持跑完第几家才会跟我说办不到?她会知道我着急,会先处理完然后邮件发给我吗?说真的,我的确不相信她能解决这个问题,我已经自暴自弃了。
果不其然,在一小时后,她电话过来说:「这边搞不定。」
我说:「用专业软件可以缩减 size 到 70%,但如何进一步压缩图像质量,需要专业人员解决。」
她在电话那头居然说:「你等等啊,我把电话交给打字员,你跟她说,我听不懂。」
后来,她整整一个礼拜没做任何别的工作,收到的投诉非常多。
B,一个男生,工作很多年,发来的合同大小写常识错误、金额不符……里面约束机构职责分工的术语描述也存在很多问题。我修改完,发过去,却再无下文。
看出问题和原因了吗?
工作不积极、不努力想办法、无法胜任稍微复杂些的问题、工作预期解决时限缺乏规划、工作有缺陷丝毫不内疚自责,工作一年或十年,仍依赖于第一个月的经验重复,工作取得进展或遇到问题,不及时反馈给关注这件事情的人。
新员工如何成长?
在临床试验行业, GCP(Good Clinical Practice,药物临床试验质量管理规范)是什么?实践。实践来自于什么?理论。理论如何植入活动?需要有人带你入行,手把手教。
这个世界上没有人有义务带你入行,别人愿意教你,花费时间精力辅导你,你要尊重她。动辄不耐烦,相信没有哪位老师愿意多一句话。
纠正错误的行动,会让你很不舒服,跳出自己的舒适区域,是需要自己内在动力的。如果你每天都在不费吹灰之力做事情,基本上你干的工作毫无价值。重复做一些不入流的工作,不可能让你成为行家里手。
我很幸运。入行就遇到一位师傅,女孩子,但没听两周,她就回家生孩子去了。我所有的知识,都是在这两周里面,观摩学习她得来的。我很感激,珍惜。
我第一次跟着老同事拜访完 PI(主要研究者),第二次就单独去谈启动会,什么都得自己搞。开启动会前,细细构思整个细节,晚上彻夜无眠……
现在培训新同事,所有人都来之前连方案都不看一眼。
培训,可以让我们变得合格。但想变得优秀些,恐怕就得经历卓越的自我修炼、专项管理、认识自己,才能提升。
我们的 PI 那么忙,自己都不准备充分,对方问起来一问三不知,还要怪 PI 不尊重你,应该去反思自己是不是足够尊重对方的时间。
CRA 的角色转变
传统意义上,CRA 的主要角色,是去确认研究中心的研究数据和关键文档是正确的。监查员的多数活动因而机械死板:按照 SOP(标准操作规程)去对表格打对勾。
尤其是在中国,多数企业老板看待监查员的形象——不过就是个收表 / 给费用的。
通过长期的行业发展,临床试验监查已经从 SDV(source data verification,原始数据核对)转变成根据研究中心的具体情况特点做培训,在遇到特异性问题时提供咨询,并管理研究中心。
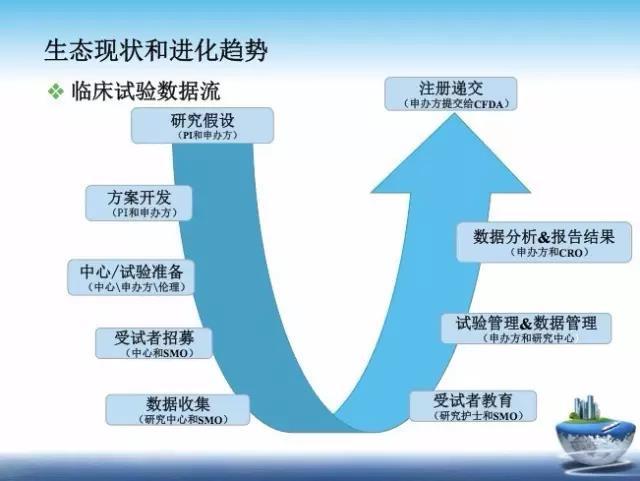
在这个角色转换的过程中,有经验的 CRA 已经不被企业看中,竞争力才是被企业欣赏的。要知道,在美国,2015 年市场新招聘的 CRA 职位超过 10,000 名。而中国,这一数字将更为可观。
纵览国内,所有一线民企 CRO 的 CRA,其监查报告中内容均为空洞无物的「是」或「否」,并未能像外企 CRA 和企业所培训那般详尽描述一份综合评估分析报告提交给申办方,并通过分析现状、问题和趋势,决定下一步纠正措施,通过良好的质量措施植入研究中心。
E6R2 的理念
如果你读过 E6R2 ,读完一定会出一身冷汗。如果再坚持十年如一日的去 SDV,明年上 315 打假的 CRA 就是你 。
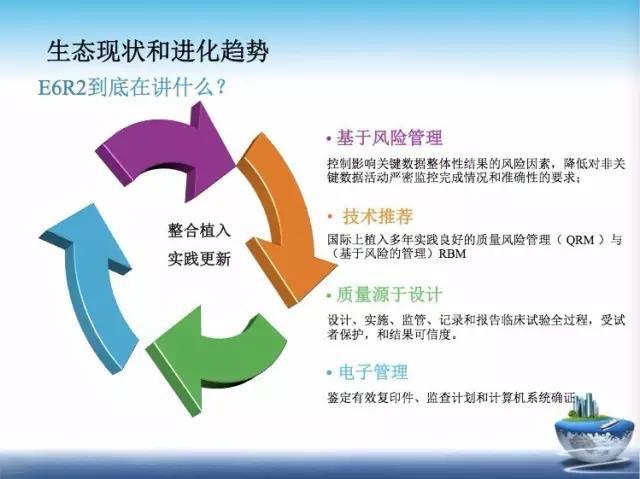
1. E6R2 其中的第一个理念是,持续优化监管流程和能力。
实际上,监查员应该是一种工艺活,需要大师级别锻造技艺,依赖言传身教,经由师傅手把手传授技巧,并注入「匠人精神」方可成就。
这种技艺打造和提升,往往离不开脚踏实地学徒制度和岗位实训。缺乏公允和合理纠正措施,每位监查员经常会有其自己做事方式。
我们也经常会遇到一些项目经理,哪怕接受同样公司教育,同样严格或不严格的 SOP 约束下,面临同样问题,你去咨询他们,往往会得出全然不同结论。
实际上,每家研究中心随着研究者熟练程度,研究走进不同阶段,我们监查计划和重点是要做相应调整的。
2. E6R2 第二个理念是,基于风险的监查。
从原文可以了解到,基于风险的监查,就是 FDA 通过长期实践发现,即便 100% 的 SDV,最终也不过发现 3% 的数据差异,这些数据如果非关键数据的话,不会影响 FDA 的结论。
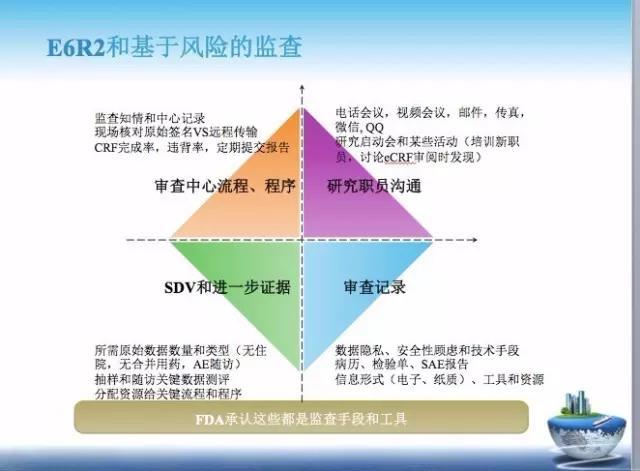
所以,FDA 认为应强调对关键数据做 100% 的数据核查。例如,知情同意和许可过程(ICF 永远都是 100% 核查的),研究入排过程(排除高风险人群,纳入最合理受益的人群),研究给药(确保剂量和疗程充分),禁忌/合并用药(避免药物干扰和影响安全性),缺失的数据(是否影响评估),缺失的检查对安全性和疗效评估影响,疗效终点,治疗终止或失访可能的原因……
目前美国已经施行电子知情同意形式,直接电子采集原始数据、日记卡、病例报告等。在远程监查这部分,利用成熟的试验管理系统,由统计分析和数据管理部门作出中枢化监查,医学监查员和监查员共同决定现场拜访监查的中心和频次。
国际上有了成熟的电子管理系统,中枢化管理平台。可以预见,中国也将走入新的发展时期。
3. E6R2 的第三个理念是质量管理系统,监查计划。
虽然我们并不是 ICH 成员国,我们做中国注册上市的试验并不需要遵循 E6R2。但是,这种基于关键流程和细节,分配关键资源的理念和意识,对我们非常重要。
国内一些不好的风气是不承认现实,要知道,美国如此强大,都承认资源不足,我们凡事 100% SDV 有什么意义呢?如果这些小细节并没影响到数据的真实性、完整性和受试者伦理保护呢?
例如,我到某家企业的时候,我说所有 CRA 必须抓三件事情:
1.知情同意签署和文件必须做到 100% 没问题。
2.研究入排标准必须做到 100% 核对可溯源。
3.每次随访不漏做任何检查。
我相信只要做到这三条,致命性的缺陷已经不太可能存在,而且最重要的是,你在这个过程中每月会熟练,我们的工作重心会调整。
所以,这个核心理念:抓重点,抓关键流程,确保关键数据输出达到标准。
4. E6R2 第四个理念,在于强调 PI 和申办方的监管能力和职责强调。
新加入职员,PI 在授权职责分工时,应通过培训,确保该员工具有完成工作的能力。
同样的,对于申办方外包工作职责给 CRO 时,也应通过合同形式转移职责,并保留最终责任到申办方。
然而,国内很多企业都没有自己的 SOP,质量管理体系、工作衔接更无从谈起。当一位 Monitor 离开一个研究时,前来交接工作的继任者往往采用另外一种不同工作方式,导致研究中心适应新规则期间陷入困惑和低效境地。
因此,我们常听到研究者抱怨:某某 CRO 公司啊,我一年给他们三波 CRA 培训,这哪是交接工作,这是折腾我啊。
我们很惊奇的发现,哪怕很严谨外企,培训出的 CRA,其工作水准和方式,仍然存在着泾渭之别,差异巨大。
实际上,我们对 GCP 认知不可避免带有个人理解,是导致这种情景本质原因。
临床研究的变更和现状
临床试验目前发展经历六个阶段,考虑到 4~6 阶段基本上和中国内资企业没什么关系,我们就介绍前面三个阶段吧,分别是纸质阶段、半纸质半电子阶段、全电子化阶段。
Stage1:所有过程均基于纸质手动工作。原始数据产生,原始数据核查,填写入病例报告表全都手动;
Stage2:大部分国内企业在 2016 年以前水平长期停滞于这个阶段。原始文档产生,原始数据核查纸质版,然后纸质版数据录入一份纸质版 CRF,再双人录入到电子模拟 CRF 中。
这种模式长期在中国应用,因为 DM 的人工较低,或者是纸质版数据直接填报到电子 CRF 中(这是目前外企在中国长期使用的方式)。
Stage3:原始文档电子化,核对电子化,CRF 报告基本上无需核对,基于远程接触即可完成中枢化监查。国外最不入流的企业也已经处于 Stage3 水平。
第 4 到 6 阶段分别是什么呢?借助于电子化技术,先开始远程监查,慢慢到中枢监查,现在是基于风险的监查并且强调 Site Management。这也是我宣扬的六阶段临床试验监管能力和效率理论。
在中国,未来将长期停留在 2.5 阶段,实际上,我们在理念上,完全可以到达第 6 阶段。
至少,我们可以借助日益发展的工具,完成上述三个阶段转化,监察员在面临时代迁移迎接这三个不同阶段时,势必要完成自我升级,自我变革。记住
我们不是收表的!但我们还需要改变自己,用坚实的行动力,学习能力,拥抱改变,避免被淘汰。
请所有的 CRA,都能随时问问自己,除了积累的经验,我到底有什么核心竞争力?
好文章,需要你的鼓励