


绵阳市中心医院联合华中科技大学同济医学院附属协和医院等 3 家医疗机构揭示肾癌转移的新机制与潜在诊疗靶点:miR-222-3
绵阳市中心医院泌尿外科团队联合华中科技大学同济医学院附属协和医院、湖北医药学院附属襄阳第一人民医院、西安交通大学第一附属医院于 2025 年 3 月在《Cell Death Discovery》(Q1,IF = 6.1)发表文章「The feedback loop between miR-222-3p and ZEB1 harnesses metastasis in renal cell carcinoma」。研究针对肾癌转移机制不明问题,探究了 miR-222-3p 作用,发现其促转移机制及可作诊疗靶点,为肾癌的诊疗带来了新的曙光。

肾癌作为泌尿系统中一种常见且极具侵袭性的恶性肿瘤,近年来其发病率和死亡率呈上升趋势。据统计,2022 年全球范围内有 434,419 例新发病例,155,702 人因肾癌失去生命。更令人担忧的是,约三分之一的患者在确诊时已出现局部或远处转移,即便接受了肾切除术,仍有近 25% 的患者会出现远处复发。由于肾癌具有高转移潜力且对传统治疗手段耐药,导致转移性肾癌患者的预后极差,5 年生存率仅约 10%。因此,深入探索肾癌转移的分子机制,寻找有效的诊断和治疗靶点迫在眉睫。
为了攻克这一难题,来自绵阳市中心医院、华中科技大学同济医学院附属协和医院、湖北医药学院附属襄阳第一人民医院、西安交通大学第一附属医院等 4 家国内医疗机构的研究人员展开了深入研究。
在这项研究中,研究人员运用了多种关键技术方法。首先,通过对肾癌组织和细胞进行微小 RNA 测序(miRNA sequencing),筛选出与肾癌转移相关的关键 miRNA。接着,利用定量逆转录聚合酶链反应(qRT-PCR)技术,检测 miRNA 和相关基因的表达水平。此外,染色质免疫沉淀(ChIP)实验则用于探究转录因子与基因启动子区域的结合情况。在细胞实验方面,采用伤口愈合实验(wound healing assay)和 Transwell 侵袭实验(invasion assays)评估细胞的迁移和侵袭能力。动物实验上,构建了皮下移植瘤模型和尾静脉注射转移模型,以观察肾癌在体内的生长和转移情况。同时,研究中还使用了外泌体分离技术(exosome isolation),对肾癌相关外泌体进行研究。样本队列来源于华中科技大学同济医学院附属协和医院泌尿外科的 82 例肾癌患者,为研究提供了有力的临床依据。
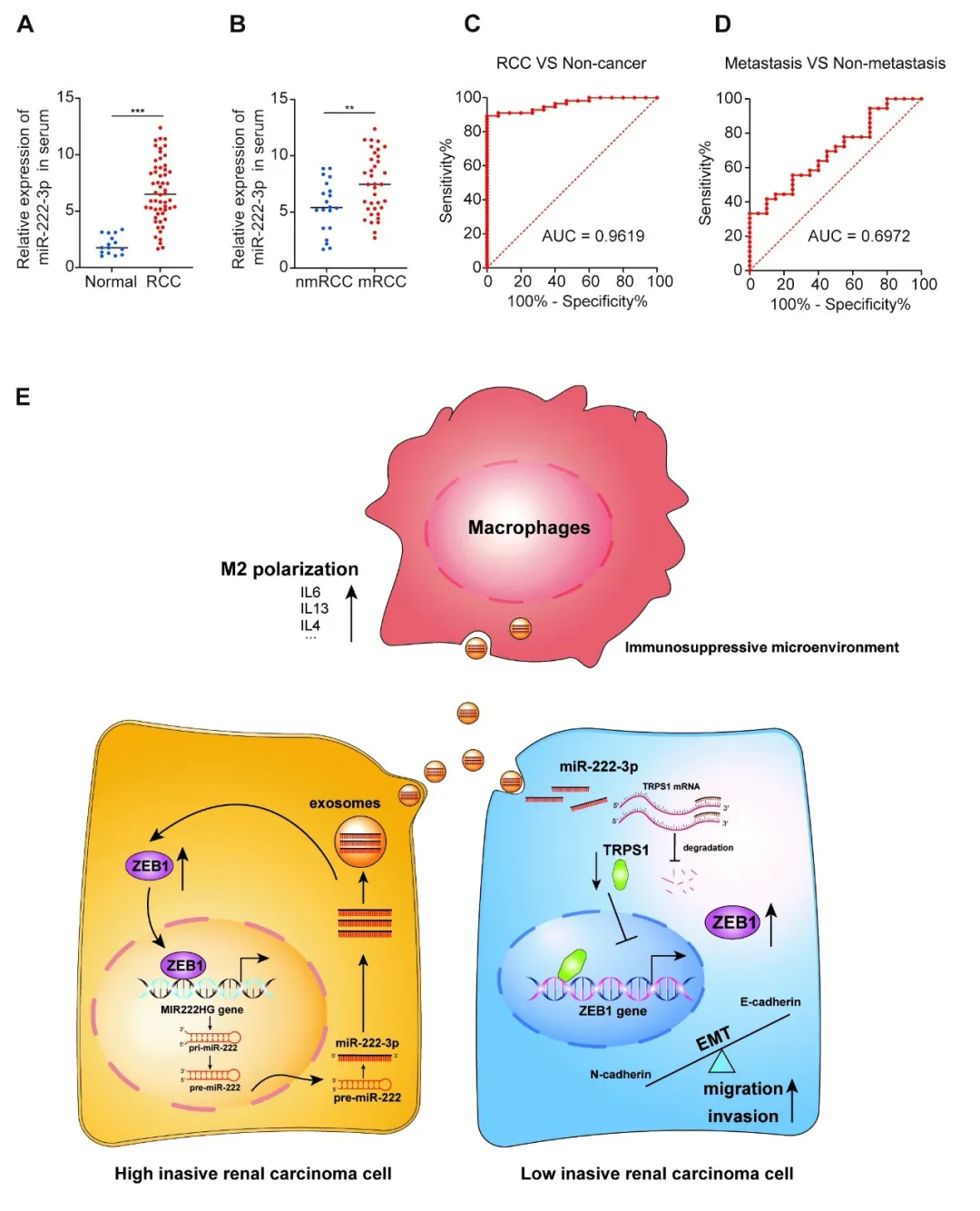
本研究揭示了外泌体 miR-222-3p 通过多维度机制促进肾癌转移的恶性循环:在转移性肾癌中高表达的 miR-222-3p 通过外泌体介导侵袭性传递,靶向抑制 TRPS1 基因解除对 ZEB1 的转录抑制,进而激活上皮-间质转化(EMT)并增强肿瘤细胞侵袭性;同时诱导巨噬细胞 M2 极化形成促转移微环境,而 ZEB1 反过来通过正反馈环路持续激活 miR-222-3p 表达。临床数据显示 miR-222-3p 在患者血液中具有高诊断价值(AUC = 0.9619),其表达水平与转移风险和不良预后显著相关,该发现为肾癌转移的分子机制提供了新见解,并为开发预后标志物和靶向治疗策略奠定了理论基础。
作者心得
本研究始于对肾癌转移分子机制的探索。通过对 8 例转移/非转移肾癌样本的 miRNA 测序,我们筛选出 miR-222-3p 作为潜在驱动因子。随后的功能实验表明,高侵袭性肾癌细胞通过外泌体递送 miR-222-3p,诱导受体细胞的迁移和侵袭能力提升,这一发现揭示了肿瘤细胞间传递恶性表型的新型途径。机制层面,我们通过多数据库联合分析锁定 TRPS1 为 miR-222-3p 的直接靶点,并证实其通过抑制 ZEB1 转录调控 EMT 进程。有趣的是,ZEB1 作为转录因子反向上调 miR-222-3p 表达,由此形成的正反馈回路解释了该分子持续高活化的内在逻辑。
在转化医学层面,82 例临床样本分析显示,miR-222-3p 在转移性肾癌组织和外周血中显著富集,其诊断效能(AUC = 0.9619)提示其作为液态活检标志物的潜力。而动物实验中观察到的 M2 巨噬细胞极化及肺转移增强现象,进一步验证了该分子在塑造转移前微环境中的关键作用。这些发现系统性地描绘了 miR-222-3p 通过外泌体-TRPS1/ZEB1 轴驱动肾癌转移的多层次调控网络,不仅为理解肿瘤恶性进展提供了新视角,更凸显了靶向外泌体信号传递或反馈环路关键节点在治疗开发中的科学价值。未来研究需在更大队列中验证其临床转化可行性,并探索基于该通路的联合干预策略。
好文章,需要你的鼓励













