8 月 16 日,国家自然科学基金委员会网站在显著位置,报道南京医科大学第二附属医院副院长、普外科主任张业伟教授在肝癌肿瘤微环境研究方面取得最新进展。

2024 年 7 月,南京医科大学第二附属医院普外科(肝胆胰脾中心)张业伟教授以唯一通讯作者在 Signal Transduction and Targeted Therapy (IF = 40.5) 期刊在线发表题为「Semaphorin 3C (Sema3C) reshapes stromal microenvironment to promote hepatocellular carcinoma progression」的研究论文。
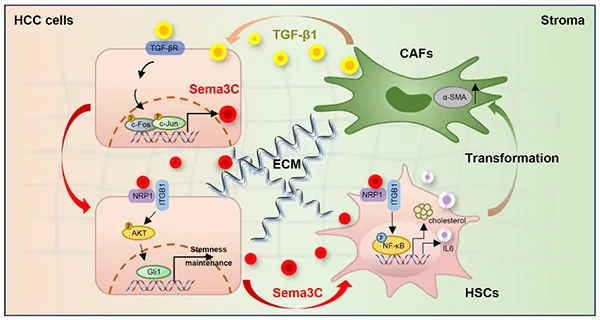
张业伟教授研究团队对肝纤维化数据的挖掘及验证发现,信号蛋白 Sema3C 在纤维化肝脏组织、HCC 组织、HCC 患者外周血以及索拉非尼耐药的 HCC 组织和细胞中表达显著上调,并与 HCC 中 CSCs 特性的获得相关。通过转录组测序,进一步发现神经纤毛蛋白-1(NRP1)和整合素β1(ITGB1)是 Sema3C 的关键功能受体,两者通过激活下游 AKT/Gli1/c-Myc 信号通路,以增强 HCC 的自我更新和肿瘤起始。此外,HCC 细胞衍生的 Sema3C 促进了体内细胞外基质(ECM)的收缩和胶原蛋白沉积,同时也促进了肝星状细胞(hepatic stellate cells,HSCs)的增殖和激活。深入研究发现,Sema3C 与 HSCs 表面的 NRP1 和 ITGB1 结合,激活下游 NF-κB 信号通路,从而刺激白介素 6(IL-6)的释放,增加 3-羟基 3-甲基戊二酰辅酶 A 还原酶(HMGCR)的表达,进而促进肝星状细胞中胆固醇的合成。同时,CAFs 分泌的转化生长因子-β1(TGF-β1)通过激活激活蛋白 1(AP1)信号,增加 HCC 细胞中 Sema3C 的表达,形成一个加速肝癌进展的正反馈循环。而阻断 Sema3C 能有效抑制肿瘤生长,并增加 HCC 细胞对索拉非尼的敏感性。

张业伟教授团队研究发现 Sema3C 作为一种新型生物标志物,在 HCC 的发生中起到促进 CSCs 和肿瘤基质之间交互的重要作用,为提高 HCC 治疗效果和克服耐药性提供了理论依据。相关工作得到了国家自然科学基金委重大科研仪器研制项目、重点项目和江苏省科技计划专项资金(重点研发计划项目)等资助。
好文章,需要你的鼓励
















