来源:首都医学科学创新中心
2025 年 12 月,首都医学科学创新中心冷方伟教授在国际期刊 Cell Reports 上发表文章 「FoxP3 forms a head-to-head dimer in vivo and stabilizes its multimerization on adjacent microsatellites」,该研究不仅解决了 FoxP3 DNA 结合模式和特异性的长期疑问,也为转录因子在染色质结构、转录调控和免疫稳态中的功能提供了新的见解。
调节性 T 细胞(Tregs)通过多种机制发挥免疫抑制功能,在维持自身免疫耐受过程中发挥关键作用,Tregs 功能失调与多种自身免疫疾病密切相关。而在肿瘤微环境中,Tregs 过度活跃则会抑制抗肿瘤免疫反应,阻碍免疫治疗的效果。FoxP3 是调节性 T 细胞的关键转录因子,在调节性 T 细胞的发育和功能中发挥重要作用。FoxP3 基因突变会引发一系列自身免疫疾,特别是 FoxP3 的 DNA 结合区域(DBD),最容易发生致病突变,也是目前研究最为广泛的区域。
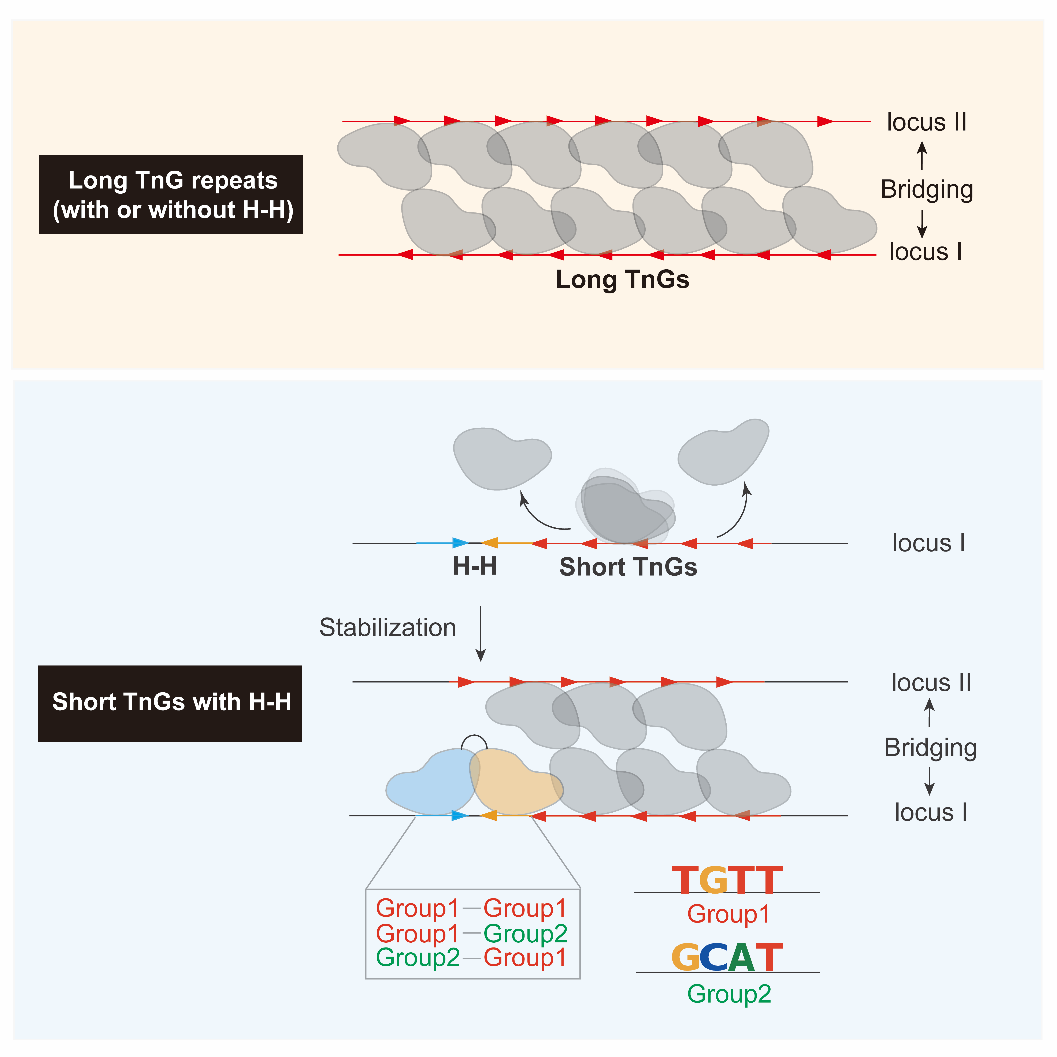
与同家族的其他 forkhead 转录因子不同,FoxP3 对单一 forkhead 基序(FKHM)的结合效率很低,传统的 ChIP-seq 和 CUT&RUN 等测序方法在 FoxP3 的结合位点中也未观察到明显的 FKHM 富集,这一现象长期以来令研究者困惑。为了明确 FoxP3 如何在转录调控层面影响控制 Tregs 的发育与功能,科研人员一直致力于揭示 FoxP3 在基因组中的结合位置。Sun Hur 团队此前的研究表明,FoxP3 通过其独特的头对头(head-to-head, H–H)二聚体结构识别两个反向重复的 FKHM(IR-FKHM)(Immunity, 2022)。在 H-H 二聚体基础上,FoxP3 还能通过进一步多聚化识别和桥接多个 TnG 微卫星 DNA 位点,在体内重塑染色质三维结构,以协调 Tregs 的基因调控网络(Nature, 2023; Molecular Cell, 2025)。然而,FoxP3 在 Tregs 中的生理结合位点极为丰富,除了 TnG 微卫星 DNA 和富集程度不高的 IR-FKHM 外,FoxP3 是否还能够以 H-H 二聚体结构识别其他 DNA 序列,仍有待进一步研究。
在本研究中,研究人员通过研究 FoxP3 蛋白对随机 DNA 序列的结合亲和力,鉴定出了一系列 FoxP3 偏好的序列基序。进一步分析显示,这些基序在 FoxP3 的生理结合位点中显著富集,并呈现明显的头对头特征,首次为 FoxP3 在体内形成头对头二聚体提供了有力证据。值得注意的是,绝大多数头对头基序都紧邻 TnG 微卫星 DNA,尤其是那些与 FoxP3 结合较弱的短 TnG 微卫星区域,头对头二聚体可在这些位点上「启动」并稳定 FoxP3 的多聚化。这种头对头二聚体和多聚体结合模式之间的协同作用是 FoxP3 增强其作为全局染色质结构关键调控因子功能的独特特征。
调控 Tregs 的免疫抑制功能在缓解自身免疫疾病和增强肿瘤免疫治疗效果方面展现出巨大的临床应用潜力,开发靶向 FoxP3 头对头二聚体的药物有助于丰富自身免疫疾病和肿瘤免疫治疗策略。
首都医学科学创新中心冷方伟和哈佛医学院 Ryan Clark 为本文的共同第一作者,Sun Hur 教授和王曦博士是通讯作者。上海交通大学免疫研究所张文翔,哈佛医学院 Thibault Viennet、Haribabu Arthanari 以及首都医学科学创新中心博士生王翠蝶也为研究做出贡献,研究受 NIH 和 HIMM 资助。
好文章,需要你的鼓励
















