来源:雨露肝霖
第 76 届美国肝病研究学会年会(AASLD 2025)于当地时间 2025 年 11 月 7 日至 11 日在美国华盛顿举行,肝霖君与您分享相关重要内容。
抗原特异性 CD8+ T 细胞是清除 HBV 的关键效应细胞,但 HBV 慢性感染常导致 CD8+ T 细胞耗竭。细胞外基质蛋白 1(ECM1)作为维持肝脏微环境稳态的重要成分,参与调控免疫应答。在本次 AASLD 2025 大会摘要上,南方医科大学南方医院李咏茵教授团队发表了关于 ECM1 在恢复 CD8+ T 细胞应答及促进 HBsAg 清除中的作用机制研究; 长庚大学发表了关于 具有肝毒性及先天样特征的 CD38+HLADR+CD8+ T 细胞与慢乙肝患者 HBV 特异性免疫应答的关联。
研究一
分泌型 ECM1A 通过阻断整合素β1 恢复 HBV 特异性 CD8+ T 细胞应答,从而促进慢性 HBV 感染中的 HBsAg 清除

研究方法
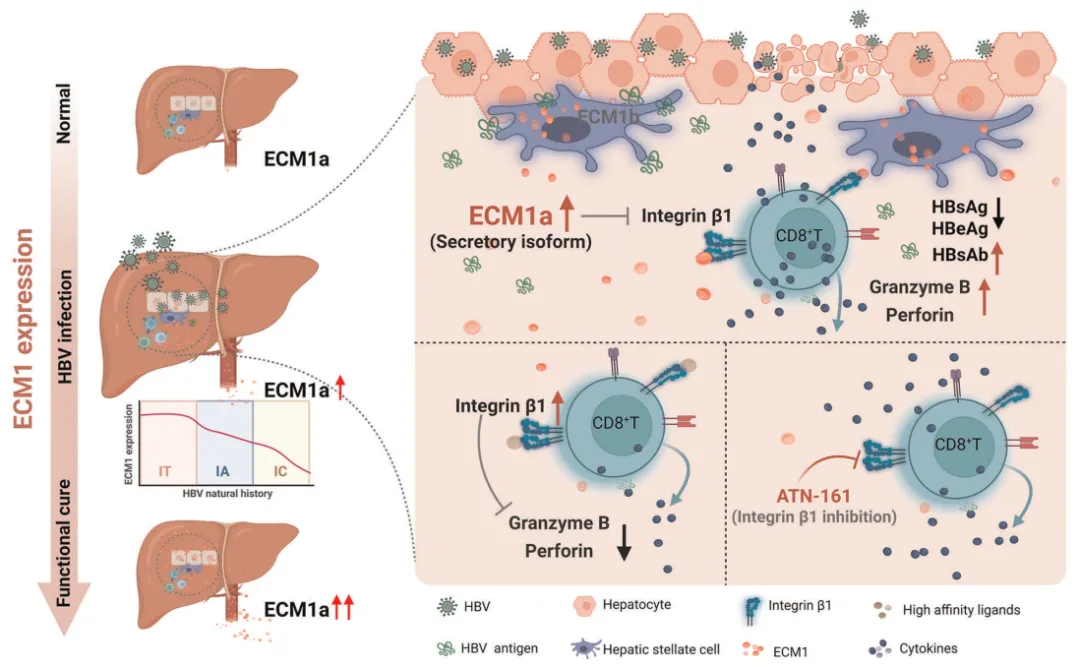
纳入 147 例慢性 HBV 感染者及 76 例健康对照者,收集其血液及肝脏样本。通过整合单细胞 RNA 测序、免疫共沉淀、质谱分析及体外刺激实验等多组学技术,系统评估细胞外基质蛋白 1(ECM1)对抗 HBV CD8+ T 细胞免疫应答的影响。并建立 HBV 小鼠模型,通过肝星状细胞(HSC)特异性敲除 ECM1 基因进行体内验证。
研究结果
通过 GEO 数据库分析发现,在 HBV 感染的肝脏样本中,有六种细胞外基质组分(MMP2/7、ECM1、VCAN、COL5A1/15A1)的表达水平 升高。在研究队列中,血清 ECM1 是唯一与疾病状态相关的组分,其水平在实现 HBsAg 清除的患者中显著高于持续感染者。
对临床肝脏样本和小鼠模型的检测表明,高水平的 ECM1 来源于肝星状细胞(HSCs)。功能上,分泌型的 ECM1a(而非非分泌型的 ECM1b)增强了 HBsAg 特异性细胞毒性 T 细胞(CTL)应答,从而促进 HBsAg 清除。此外,在小鼠中敲低 HSC 特异性 ECM1,延迟了 HBV 的清除。
机制上,ECM1a 所特有的 P300-H314 结构域(ECM1b 缺失)与整合素β1 结合,消除了整合素 1 对 CD8+ T 细胞功能的抑制作用,恢复抗 HBV 免疫应答。同时,单细胞测序显示,慢性 HBV 感染者外周血和肝内 CD8+ T 细胞上整合素 1 的减少与临床治愈及对聚乙二醇干扰素α(PEG IFNα)治疗的良好应答相关。与此相符的是,使用 ATN-161 对整合素 1 信号通路进行药物抑制,能够加速 HBV 小鼠模型中的病毒清除过程。
研究结论
分泌型异构体 ECM1a 通过抑制整合素 1 介导的 CD8+ T 细胞耗竭,促进细胞毒性细胞因子生成并加速 HBsAg 清除,从而有效清除 HBV。 本研究揭示了细胞外基质与免疫系统间的新型交互机制,并发现 ECM1 是慢性 HBV 感染的潜在治疗靶点。
研究二
肝毒性样 CD38+HLADR+PD1+CD8+ T 细胞:一个与慢乙肝患者 HBsAg 降低和 HBV 特异性免疫相关的功能独特的细胞亚群

研究方法
前瞻性纳入 43 例 ALT ≥ 2 倍正常值上限(ULN)的慢乙肝患者。采用单细胞 RNA 测序分析外周 CD8+ T 细胞,并通过流式细胞术验证细胞表型。利用 IFN-γ酶联免疫斑点测定法(ELISpot)评估核心抗原、聚合酶抗原、X 抗原及 S 抗原特异性 T 细胞应答。通过线性回归分析,探究 T 细胞亚群、HBV 特异性免疫应答与治疗期间 HBsAg 清除速度之间的关联性。
研究结果
通过单细胞测序技术发现了一群外周 CD8+ T 细胞亚群,该细胞群被定义为 具有肝毒性转录组特征的 CD38+HLADR+ CD8+ T 细胞。该细胞亚群展现出独特的转录特征,表现为 NK 受体通路和细胞因子响应模块的富集,并且其先天样评分显著高于其他 CD8+ T 细胞亚群。
进一步分析发现,CD38+HLADR+ CD8+ T 细胞亚群可细分为 PD1+和 PD1-亚群。对于治疗前存在活动性肝炎的慢乙肝患者,PD1+CD38+HLADR+ CD8+ T 细胞的频率与治疗期间 HBsAg 的下降速度显著相关(估计值:0.626,p < 0.01)。此外,该亚群与 HBV 核心抗原及 HBsAg 特异性 T 细胞应答也存在显著相关性(7.511,p < 0.01;3.812,p < 0.05)。然而,在 PD1-亚群中未观察到上述特征,表明 CD38+HLADR+ CD8+ T 细胞亚群存在 功能异质性,并可能与 HBV 特异性 CD8+ T 细胞的功能恢复存在潜在关联。
研究结论
PD1+CD38+HLADR+ CD8+ T 细胞具有肝毒性转录组学特征,该亚群的频率与 HBV 核心抗原和 HBsAg 特异性 T 细胞应答显著相关,并与治疗期间 HBsAg 下降密切相关。因此,该亚群可能与 HBV 特异性 CD8+ T 细胞应答的恢复密切相关,并有助于 HBsAg 清除。
肝霖君有话说
临床治愈是当前慢乙肝最理想的治疗终点,而免疫调节是实现临床治愈的重要方式之一。本文的两项研究聚焦 HBV 特异性免疫应答中至关重要的 CD8+ T 细胞,为开发更精准、高效的免疫治疗策略提供了全新视角:
外周及肝内 CD8+ T 细胞上整合素β1 水平降低与 PEG IFNα的良好应答相关,提示通过靶向整合素 1 等通路与 PEG IFNα协同联合,可能是未来实现更高 HBsAg 清除率的可行方向。
前期研究表明,CD300A+CD8+ T 细胞可作为预测 PEG IFNα治疗应答的有效生物标志物。而 CD38+HLADR+ CD8+ T 淋巴细胞比例/功能与 PEG IFNα治疗的应答持久性相关,PD1+CD38+HLADR+ CD8+ T 细胞亚群也与 HBV 特异性免疫应答及 HBsAg 下降密切相关,该亚群是否同样可用于预测慢乙肝患者的治疗应答,为制定个体化治疗策略提供依据?
相信对慢乙肝免疫机制的持续探索,最终将为实现高效的个体化临床治愈提供关键路径。
参考文献:
[1] Dong ZY, Chen P, Zhou YX, et al. Secretory ECM1A restores HBV-specific CD8° T cell response via integrin β1 blockade to promote HBsAg loss in chronic HBV infection. AASLD2025, Abstracts (0049).
[2] Huang HW, Jeng RWJ, Lin CW, et al. Hepatotoxic-like CD38+HLADR+PD1+CD8+ T cells define a functionally distinct subset associated with HBsAg reduction and HBV-specific immunity in CHB. AASLD2025, Abstracts (1166).
好文章,需要你的鼓励
















