来源:雨露肝霖
编者按
第 76 届美国肝病研究学会年会(AASLD 2025)将于当地时间 2025 年 11 月 7 日至 11 日在美国华盛顿举行,肝霖君与您分享相关重要内容。
在采用聚乙二醇干扰素α(PEG IFNα)治疗慢乙肝的过程中,部分患者可能出现 HBsAg 下降逐渐停滞而进入平台期,已有研究表明,此时采用间歇治疗策略是解决 PEG IFNα应答疲劳的重要方式,可有效提升 HBsAg 清除率,但其中的免疫学机制尚不明确。首都医科大学附属北京地坛医院谢尧教授和李明慧教授团队在本次 AASLD 2025 大会摘要上发表了多项相关机制研究,初步探索了 HLA-DR+CD38+CD8+ T 淋巴细胞、自然杀伤(NK)细胞及树突状细胞(DCs)在 PEG IFNα间歇治疗期间频率和功能的变化。
研究一
HLA-DR+CD38+CD8+ T 淋巴细胞比例/功能与 PEG IFNα治疗慢乙肝的应答持久性的相关性

研究方法
将慢乙肝患者分为 3 组:初治组、核苷(酸)类似物(NAs)经治组和 PEG IFNα治疗平台期组。在完成基线评估后,初治组及部分 NAs 经治组患者启动 PEG IFNα治疗。对于经 PEG IFNα治疗进入平台期(表现为 HBsAg 下降停滞)的患者,停用 PEG IFNα,并在间歇期后重新开始治疗。通过采集外周血样本,在特定时间点评估临床指标,并利用流式细胞术分析 HLA-DR+CD38+CD8+ T 细胞的表型及功能。
研究结果
共纳入 151 例患者,其中 53 例为初治患者,51 例为 NAs 经治患者,47 例为经 PEG IFNα治疗进入平台期的患者。HLA-DR+CD38+CD8+ T 细胞进一步分为 HLA-DR+CD38dim 和 HLA-DR+CD38 hi 两个亚群。
在 PEG IFNα治疗期间,初治组和 NAs 经治组患者均出现 HLA-DR+CD38dim 亚群的初始激增(P 均< 0.0001),随后显著下降(P 均< 0.0001),而 HLA-DR+CD38 hi 亚群则显著增加(P 均< 0.0001;图 1A - B)。
在经 PEG IFNα治疗进入平台期的患者中,停药 12 - 24 周后,HLA-DR+CD38dim 亚群出现回升(P < 0.0001),而 HLA-DR+CD38 hi 亚群则下降(P < 0.0001)。PEG IFNα再治疗 12 - 24 周后,HLA-DR+CD38dim 亚群再次下降(P < 0.0001),而 HLA-DR+CD38 hi 亚群则增加(P < 0.001;图 1C),同时,与基线相比,HBsAg 水平显著降低(P < 0.05)。
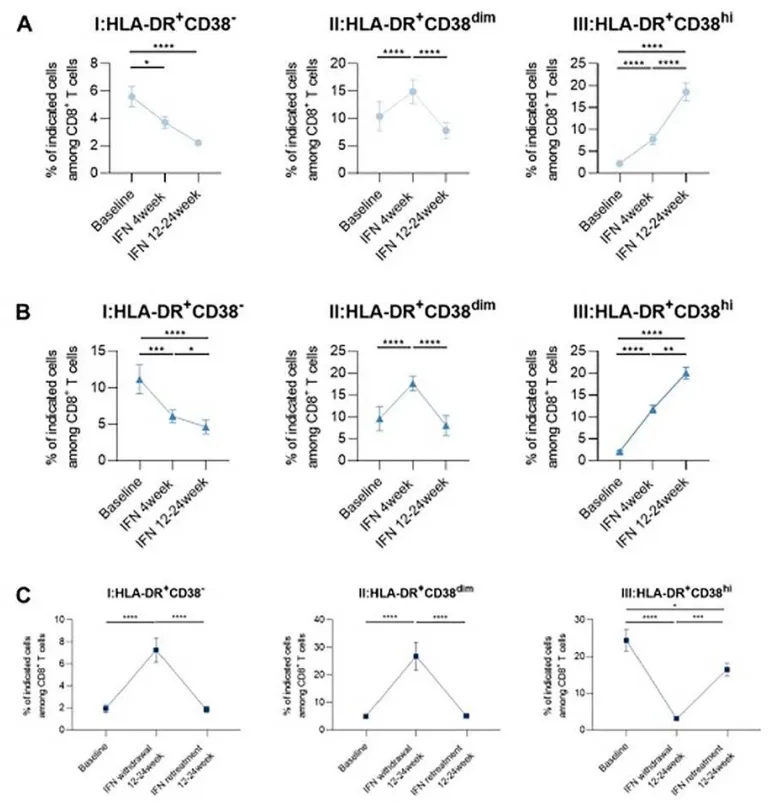
图 1. PEG IFNα治疗期间 HLA-DR+CD8+ T 淋巴细胞亚群的变化
(A)初治组;(B)NAs 经治组;(C)PEG IFNα治疗平台期组
与 HLA-DR+CD38dim 亚群相比,HLA-DR+CD38 hi 细胞表现出较低的共刺激分子表达水平,并伴有细胞毒性效应功能受损(图 2)。
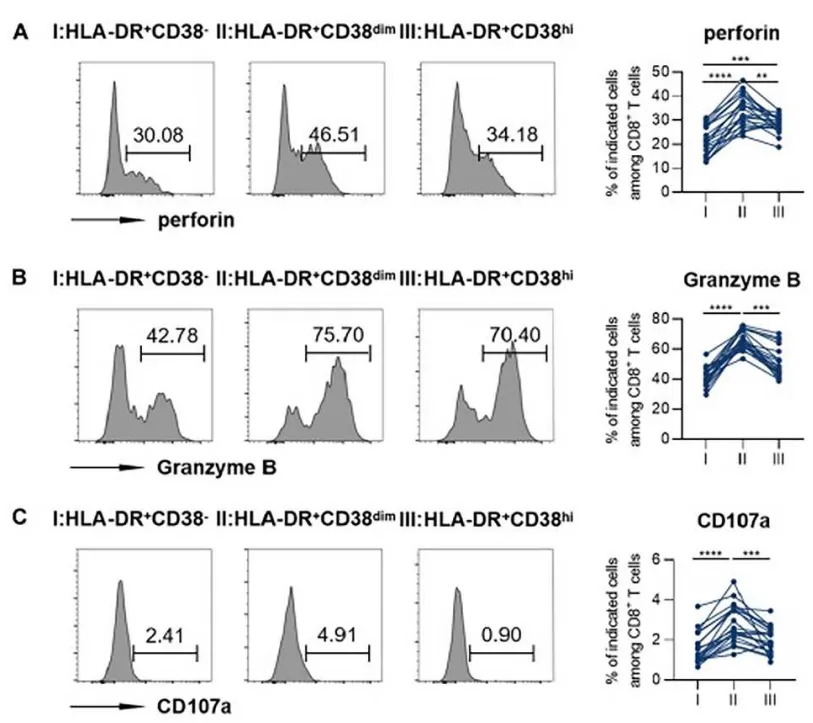
图 2. PEG IFNα治疗平台期组基线 HLA-DR+CD8+ T 淋巴细胞亚群中细胞毒性分子的表达情况
(A)穿孔素;(B)颗粒酶 B;(C)CD107a
研究结论
在 PEG IFNα治疗过程中,CD8+ T 细胞中 HLA-DR+CD38dim(活化)亚群向 HLA-DR+CD38 hi(细胞毒性受损)亚群的转变,可能是导致抗病毒疗效持续性下降的原因。采用 PEG IFNα间歇治疗策略可逆转这一趋势,突破 PEG IFNα治疗的平台期,从而恢复抗病毒活性。
研究二
自然杀伤(NK)细胞在 PEG IFNα间歇治疗中的作用

研究方法
根据抗病毒治疗情况将慢乙肝患者分为三组:初治组、PEG IFNα治疗平台期组和 NAs 治疗组。初治组接受 PEG IFNα治疗。对于 HBsAg 下降进入平台期的患者,暂停使用 PEG IFNα,12 - 24 周后重新开始治疗。NAs 治疗组继续原有治疗方案。
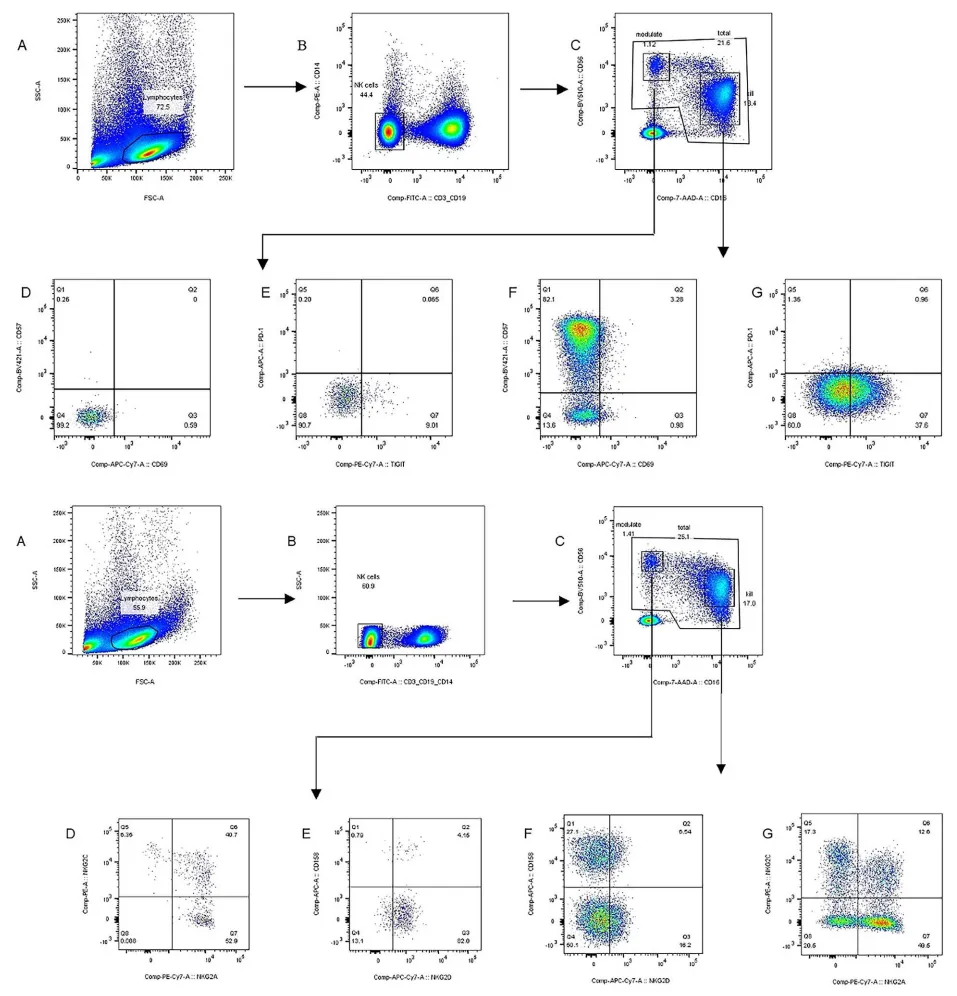
初治组的病毒学和血清学数据分别在基线、PEG IFNα治疗 4 周和 12 - 24 周时采集;平台期组的数据则在停用 PEG IFNα后、12 - 24 周间歇期结束后以及再治疗 12 - 24 周后采集。通过多色流式细胞术分析 NK 细胞表型/频率。
研究结果
本研究共纳入 207 例慢乙肝患者:初治组 68 例、平台期组 50 例、NAs 治疗组 89 例。基线数据显示,与初治组相比,平台期组的 CD56dim 和 CD56bright NK 细胞频率显著降低(P 均< 0.001),且两组亚群均呈现功能抑制特征。
在 PEG IFNα治疗期间,初治组的 HBsAg 水平持续下降。CD56dim 的频率在治疗 4 周和 12 - 24 周时显著降低(P = 0.024 和 P < 0.001),同时伴随激活受体 NKG2D(4 周时 P = 0.021)和 NKG2C(12 - 24 周时 P < 0.001)减少,而抑制性受体 NKG2A(P < 0.001)增加。CD56bright 的频率则呈现上升趋势,NKG2A 和 NKG2D 表达显著升高(P < 0.01)。
在平台期组中,CD56bright 的频率在 12 - 24 周的间歇期间显著下降(P = 0.008),但在 PEG IFNα再治疗后回升(P = 0.001)。激活标志物 CD69 在间歇期间上升(P = 0.018),再治疗后则下降(P = 0.006)。CD56dim 的频率无显著波动,但抑制性 NKG2A 在再治疗后显著升高(P = 0.001)。
研究结论
PEG IFNα治疗可减少细胞毒性 CD56dim 亚群,同时增加分泌细胞因子的 CD56bright 亚群,其活性受多种因素调控。平台期可能与该转变相关,反映出 NK 细胞在免疫调节和炎症控制中具有双重作用。
研究三
慢乙肝患者在 PEG IFNα间歇治疗期间树突状细胞(DCs)CX3CR1 的表达变化

研究方法
将慢乙肝患者分为 3 组:初治组(CHB 组)、NAs 治疗组(NA 组)和 PEG IFNα治疗平台期组(P 组)。在完成基线评估后,P 组患者在停用 PEG IFNα 12 - 24 周后重新开始治疗。
分别采集 CHB 组和 NA 组患者基线的 CX3CR1+ DCs 比例及其 CX3CR1 平均荧光强度(MFI)值;对于 P 组患者,分别在停用 PEG IFNα时、停用 12 - 24 周后及再治疗 12 - 24 周后,同步采集上述指标。
研究结果
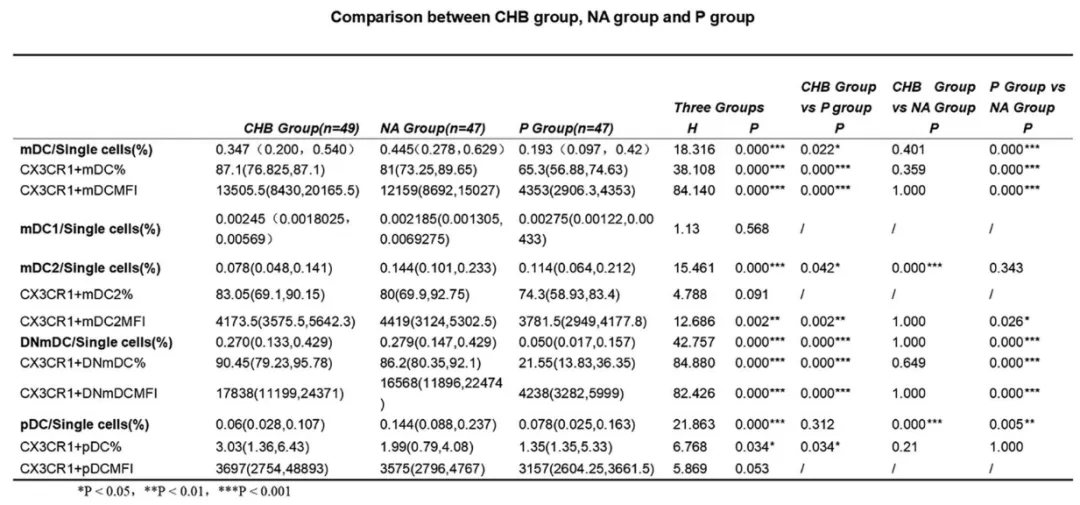
本研究共纳入 143 例慢乙肝患者:CHB 组 49 例,NA 组 47 例,P 组 47 例。
基线检测显示:P 组浆细胞样树突状细胞(pDC)中 CX3CR1+ 细胞比例、髓样树突状细胞(mDC)中 CX3CR1+ 细胞比例和 CX3CR1+ mDC 的 CX3CR1 MFI、CX3CR1+ mDC2 的 CX3CR1 MFI,以及 CD1c/CD141 双阴性 mDC(DN mDC)中 CX3CR1+ 细胞比例、CX3CR1+ DN mDC 的 CX3CR1 MFI,均显著低于 NA 组和 CHB 组。
对 P 组 35 例患者进行 12 - 24 周间歇期的随访,发现 DN mDC 中 CX3CR1+ 细胞比例及 CX3CR1+ DN mDC 的 CX3CR1 MFI 均 显著升高。 另有 11 例 P 组患者接受 PEG IFNα再治疗 12 - 24 周的随访,共获取 3 个随访时间点的数据。结果显示,DN mDC 中 CX3CR1+ 细胞比例及 CX3CR1+ DN mDC 的 CX3CR1 MFI 均呈现 先升后降 的趋势。
研究结论
在慢乙肝患者接受 PEG IFNα治疗期间,HBsAg 缓慢下降的平台期可能与外周血 DCs 上 CX3CR1 表达不足有关,尤其是 CD141/CD1c 双阴性髓样树突状细胞(DN mDC)。
肝霖君有话说
PEG IFNα具有直接抗病毒和免疫调节的双重作用,可帮助慢乙肝患者实现 HBsAg 持续清除。但 PEG IFNα的长期治疗可能会导致免疫耗竭,无法达到持续免疫应答的目的。前期谢尧/李明慧教授团队已发表了相关的研究探索,表明经 PEG IFNα治疗进入平台期的慢乙肝患者 DNmDC 频率降低、成熟受阻;激活的 HLA-DR+CD38dim CD8+ T 细胞逐渐分化为 HLA-DR+CD38 hi 亚群,杀伤功能受损。在本次 AASLD 大会中,团队再次聚焦 HLA-DR+CD38+CD8+ T 淋巴细胞、NK 细胞及 DCs,发现 HBsAg 下降进入平台期可能与这些细胞的功能受损有关,但在 12 - 24 周的间歇期后,这一趋势可逆转。可见 PEG IFNα间歇治疗有利于宿主免疫功能的恢复,从而重建机体对 PEG IFNα的敏感性,为下一阶段的治疗创造条件,最终实现临床治愈。
参考文献:
[1] Li MH, Xie Y, Lin YJ, et al. The relationship between the durability of response to interferon therapy for hepatitis B virus infection and the proportion/function of HLA-DR+CD38+CD8+ T lymphocytes. AASLD2025, Abstracts (1173).
[2] Li MH, Xie Y, Bi XY, et al. Study on the role of NK cells in intermittent interferon therapy. AASLD2025, Abstracts (1272).
[3] Li MH, Xie Y, Yang L, et al. Changes in CX3CR1 expression in dendritic cells during interferon intermittent therapy in CHB patients. AASLD2025, Abstracts (1356).
好文章,需要你的鼓励
















