来源:首都医学科学创新中心
在再生生物学领域,全身再生(Whole-Body Regeneration, WBR) 始终是备受关注的焦点议题。具备该能力的动物,甚至能够从微小的身体碎片完全重建成一个有功能的个体,展现出生命在结构重建方面的惊人潜力。尽管全身再生在低等动物中相对常见,但相关模型体系的开发仍不够系统,其生物学机制尚未被充分挖掘,研究手段与理论框架也面临显著挑战。既有研究多集中于无脊椎动物,缺乏对具脊索特征动物的系统性探讨,这一现状限制了我们从进化与发育维度理解复杂多细胞机体实现全身再生的普遍原则和调控机制。
近期,Yuval Rinkevich 实验室在 npj Regenerative Medicine 发表综述,系统梳理了动物界全身再生的分布、类型与细胞-分子基础,重点聚焦脊索动物门的尾索动物模型——簇状海鞘属(Botrylloides),尤其是模型物种 Botrylloides leachi(一种具有超强再生能力的海鞘),揭示其由微小血管碎片实现整合性全身再生的独特机制。该研究强调,此类再生模式动物与包括人类在内的哺乳动物存在显著差异,但为理解组织碎片如何重建完整个体提供了重要线索。

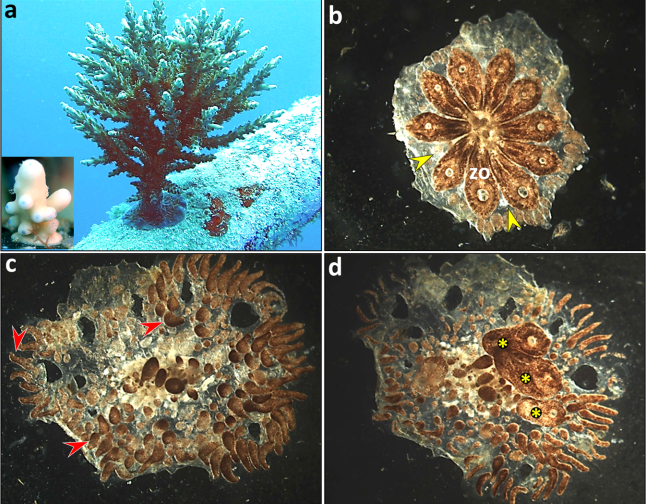
图 1. 代表性海洋无脊椎动物的全身再生机制
a. 一种轴孔珊瑚(Acropora)从一个小断枝(仅含少量珊瑚虫)再生为一个完整的大型珊瑚群体
b–d. 史氏菊海鞘(Botryllus schlosseri)在芽体切除后的再生过程
研究提出了两种全身再生模式:类型 I 以群体生物为主,依赖循环的多能成体干细胞,通过系统性诱导与多再生位点竞争,实现体细胞胚胎发生样式的全身再生;类型 II 以单体生物为主,依赖命运受限干细胞,形成单一的再生前沿(芽基/再生芽),遵循预成式的发育模式,常伴随瘢痕化愈合。文献比较表明,不同门类全身再生的触发形态(解离细胞、微小体片段或截肢)与细胞来源(既有干细胞、去分化或转分化细胞)存在显著差异。
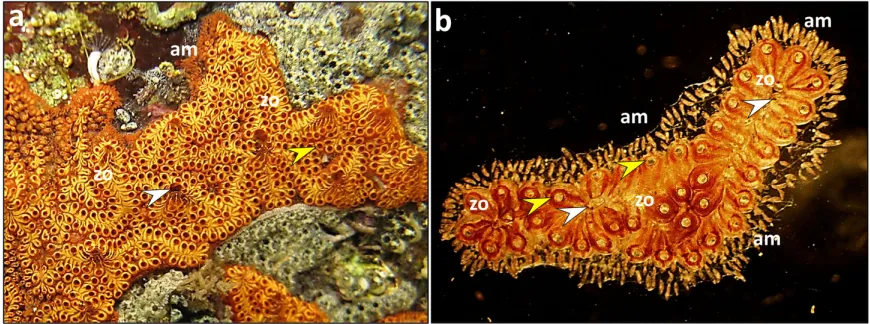
图 2. 海鞘(Botrylloides leachi)
a. 采自以色列地中海沿岸浅海硬质基底的群体
b. 实验室中生长的群体
两个群体均呈现红橙色的色型(color morphs)。
Botrylloides 属因其独特的生物学特性,是研究全身再生的理想生物学模型。这类海鞘形成胶质群体,由数千个遗传背景完全一致的个体(称为 zooids)通过共有的血管网络相互连接而成;其在胚胎发育阶段表现出典型的脊索动物特征,包括脊索和背神经管等结构。
在物种 Botrylloides leachi 中,全身再生过程起源于循环血细胞。仅需分离一个微小的血管壶腹结构(约 0.1 mm,含 100–200 个血细胞),就可在约 10 天内完成整个再生过程(图 3)。该过程包括一系列高度协调的阶段:伤口愈合、血管结构重塑、壶腹凝缩、再生生态位建立,最终发育为具有完整功能的个体。分离后,片段内血流逐渐恢复,血细胞聚集形成再生灶,并开始表达干细胞标志物 Piwi 及增殖标记 PCNA。尽管早期可出现多个再生芽基竞争性生长,最终仅有一个成功发育为成熟 zooid,其余均通过凋亡被清除。
视黄酸(RA)信号在该过程中发挥核心调控作用:抑制该通路将阻断再生,而外源性 RA 不仅加速再生,还可突破「单芽限制」,诱导多 zooid 形成。转录组分析显示,WNT、TGF-β和 Notch 等关键发育通路显著上调,组蛋白去乙酰化酶等表观遗传调控因子也参与形态发生调控。
全身再生依赖于多种循环和定居型成体干细胞,包括生殖系与体细胞谱系,这些细胞定位于「细胞岛」等特定微环境。在近缘种 Botrylloides diegensis 中,表达整合素α-6 的细胞被证明是再生所必需的。紫外线照射可干扰再生进程,影响β-连环蛋白阳性细胞的分布模式。
该属动物展示了一种脊索动物中特有的、基于血管微环境的多中心竞争性再生模式。该机制与哺乳动物的再生机制存在明显差异,为理解再生能力的进化起源及多细胞生物的修复潜能提供了重要视角。
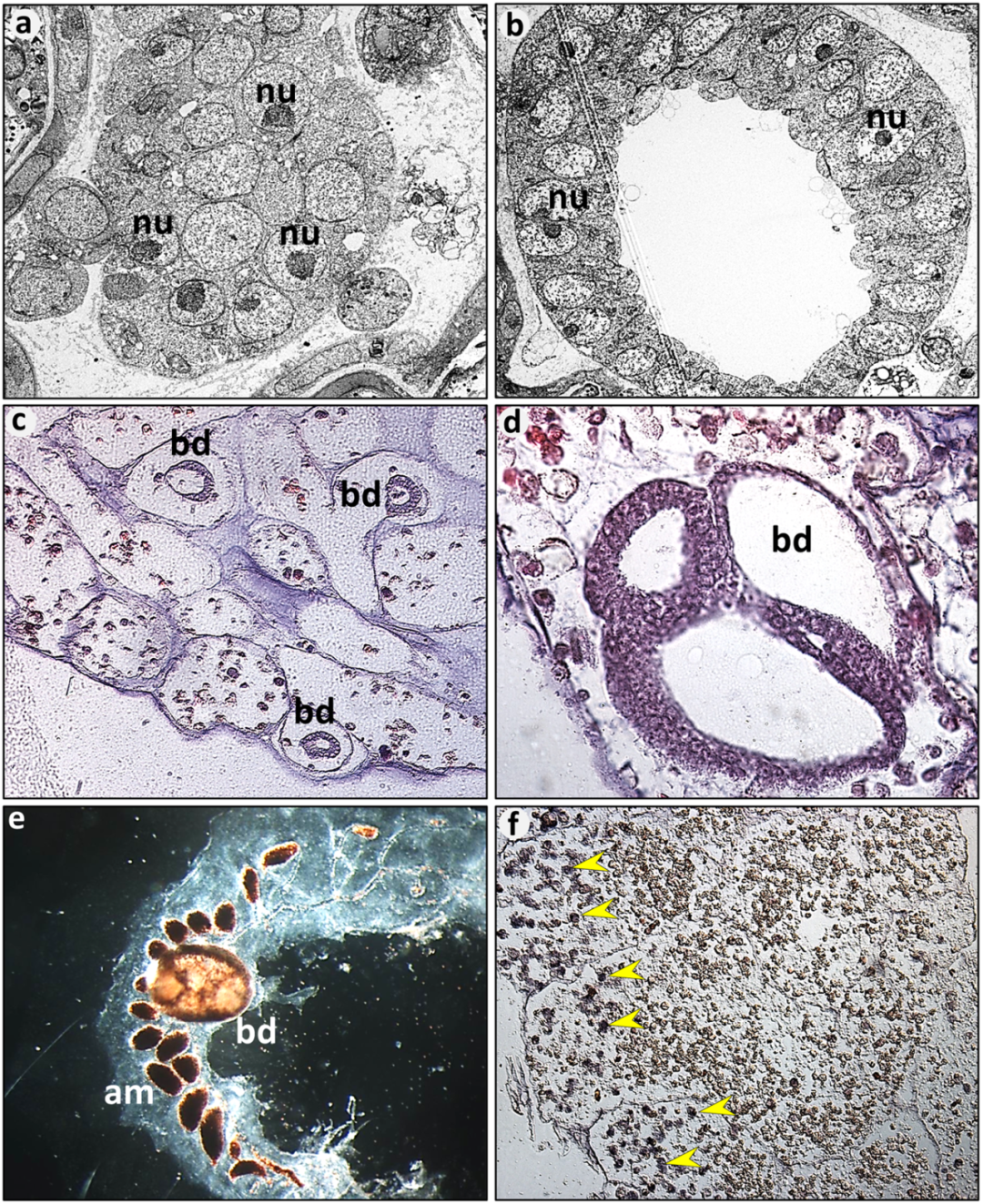
图 3. 海鞘(Botrylloides leachi)群体中的全身再生
基于 Botrylloides 这一独特模型,我们能够深入解析全身再生中系统性诱导、多位点竞争以及多能干细胞参与的核心机制,并有望揭示 Piwi、WNT 等进化上保守的基因与信号通路的调控逻辑。尽管哺乳动物整体再生能力有限,但现有研究表明,通过干预单一信号通路即可在通常不再生的物种中成功诱导再生,这提示人类可能具备比以往认知更为深刻的再生潜力。
作为脊索动物门中的无脊椎代表,Botrylloides 凭借其以系统性诱导、多再生灶竞争和多能干细胞驱动为特征的再生模式,为理解组织碎片如何实现整体重建提供了关键参照。该模型不仅为跨物种再生机制比较提供了理想窗口,也为再生医学领域的关键策略——如干细胞激活、衰老干预及肿瘤抑制——带来了新的思路。
进一步开展对 Botrylloides 的研究,将有望搭建连接无脊椎动物与脊椎动物再生研究的桥梁,显著推动跨门类比较生物学的发展,并为最终解锁高等动物的再生潜能提供理论基础与技术路径。
好文章,需要你的鼓励
















