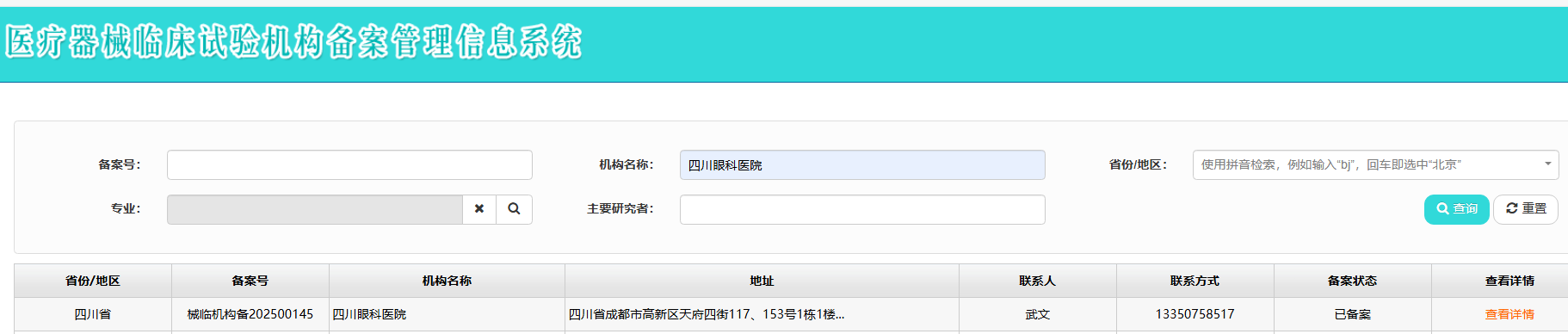
为积极响应国家医药健康产业高质量发展战略,进一步提升医院科研创新能力和学术影响力,完善医疗器械从研发到上市的全链条体系,我院自 2024 年 6 月启动全面评估,于 2024 年 12 月正式开展 GCP 备案准备工作,2025 年 2 月正式成立 GCP 机构,并于 2025 年 10 月 7 日成功在国家药品监督管理局完成医疗器械临床试验机构备案(械临机构备 202500145)、专业备案(眼科专业)及主要研究者(PI)备案。
受国家药监局委托,四川省药品监督管理局审评中心于 2025 年 11 月 25 日组织专家莅临我院,开展医疗器械临床试验备案现场检查。本次检查分为工作汇报会、现场查验及结果反馈三个环节。医院院长孙丰源,副院长兼 GCP 机构主任吴桐,爱尔眼科医院集团四川省区 CEO 万伟,以及 GCP 机构办公室、伦理委员会、眼科专业组、医务部、护理部等主要人员参加了会议。

会上,孙丰源院长代表医院对专家组的到来表示热烈欢迎与诚挚感谢,并指出开展临床试验是推动医学科技进步、提升医疗技术水平的关键路径,也是我院作为三级眼科医院及爱尔眼科区域诊疗中心的重要使命。临床试验机构成功备案,标志着我院在科研平台建设的临床转化能力方面迈上新台阶,对增强医院核心竞争力、培养高层次科研人才具有深远意义。自启动备案工作以来,医院高度重视,统筹部署,成立了专项工作组,从组织架构、制度体系、人员培训、硬件设施等各个方面进行了系统性建设和完善。

随后,GCP 机构主任、眼科专业组组长吴桐代表机构和眼科专业组,伦理委员会主任王丽娜代表伦理委员会,分别就医院概况、组织架构、人员资质、质量管理体系建设、人员培训和考核等方面进行了详细汇报。
汇报会议结束后,专家组依据 GCP 及相关法律法规,对 GCP 机构办公区、伦理委员会办公室、检验科、病区、试验参与者接待室等区域,从场地建设、设备设施的管理、标准操作规程(SOP)等方面进行了全面细致的现场核查。同时,对医疗器械 GCP 机构、眼科专业组、伦理委员会的管理制度和 SOP 等开展了深入检查,并进行了现场提问、访谈和指导。专家组对我院在 GCP 备案准备过程中展现出的高度重视和系统推进给予充分肯定,同时也给与了一些指导性建议。最终,经专家组严格评审,我院医疗器械临床试验机构及眼科专业达到备案标准。
未来,我院将紧密围绕「医、教、研、产」协同发展的战略目标,结合爱尔眼科区域中心的功能定位,恪守「以试验参与者权益与安全为核心,以严谨科学设计为根基,以推动研发成果转化为目标,以全过程质量控制为生命线」的核心原则,全面深化 GCP 规范化建设进程。我们致力于确保每一项临床试验均符合伦理准则、科学规范与国家法规,矢志将我院建设成为管理规范、运行高效的高水平临床试验机构,为我国眼健康事业发展贡献坚实力量。
好文章,需要你的鼓励