


重磅!陆道培医学团队在 Blood 期刊发表无需基因编辑的自然选择 CD7CAR-T 治疗 R/R T-ALL/LBL 首个 I 期临床研究结果
2022 年 5 月 2 日,陆道培医院陆佩华教授(第一作者和共同通讯作者)团队、河北森朗生物科技有限公司(以下简称「森朗」)李建强教授(共同通讯作者)团队(刘莹,共同第一作者)、北京大学人民医院黄晓军教授(共同通讯作者)合作在血液科国际权威期刊 Blood(IF = 23.63)发表了题为 Naturally Selected CD7 CAR-T Therapy without Genetic Manipulations for T-ALL/LBL: First-in-human Phase I Clinical Trial 的研究论文。

急性 T 淋巴细胞白血病 (T-cell acute lymphoblastic leukemia, T-ALL) 和 T 淋巴母细胞淋巴瘤 (T-cell lymphoblastic lymphoma, T-LBL) 是具有高度侵袭性的 T 系恶性肿瘤。由于正常 T 细胞和恶性 T 细胞之间共有的抗原性,目前仍然缺乏针对 T 细胞恶性肿瘤的获批 CAR-T 疗法。
CD7 在 T-ALL/LBL T 细胞表面高度表达,是潜在的 CAR-T 治疗靶点。靶向 CD7 的免疫疗法可能会受到 T 细胞自相残杀机制(fratricide)的影响。因此,在既往研究中曾采用 CRISPR/Cas9 基因编辑技术和蛋白沉默表达技术生产靶向 CD7 的 CAR-T 细胞。但是,基因编辑技术会使得 CD7 CAR-T 细胞的生产成本增加。此外,使用患者自体 T 细胞制造 CD7 CAR-T 细胞仍然具有一定难度。虽然供者来源或通用型 CD7 CAR-T 是一种选择,但寻找合适的供体、异体 CAR-T 在体内扩增能力及持续时间等问题仍有待解决。
针对上述难题,本研究开展探索,使用了森朗生物研发的患者或供者来源的,无需额外进行 CD7 基因编辑或蛋白质表达阻断的「自然选择(Naturally Selected)」CD7 CAR-T 细胞 (NS7CAR) 的新产品,并在 1 项针对 T-ALL/LBL 患者的 1 期临床试验中首次探索了 NS7CAR 疗法在人体内的安全性和有效性。
临床前研究
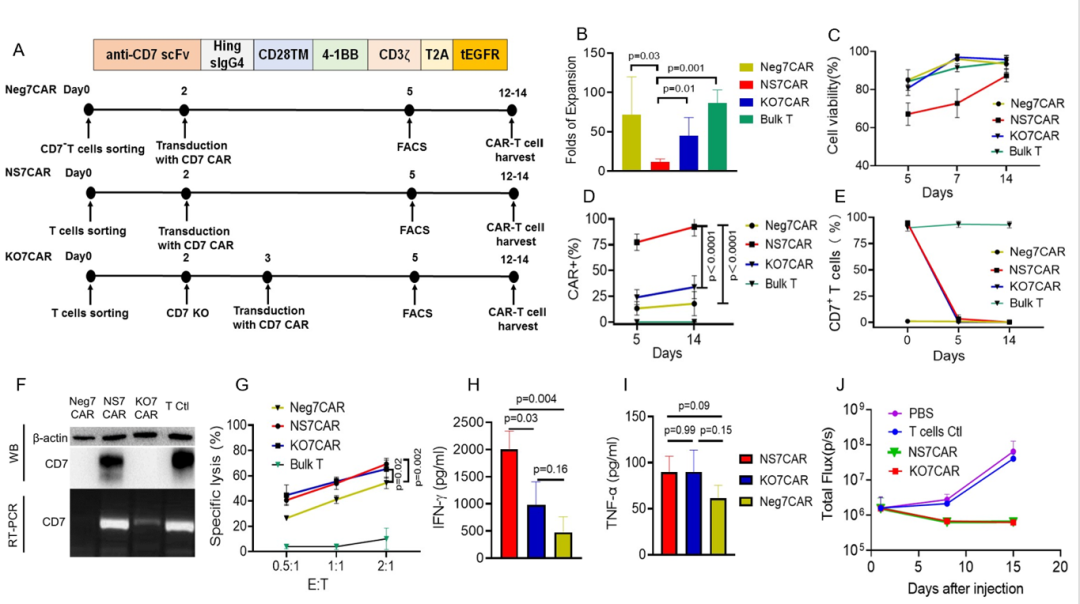
研究者使用三种不同的方法制造了靶向 CD7 的 CAR-T 细胞并比较它们的功能:1)NS7CAR:通过用 7CAR 转导总 T 细胞,然后对其进行「自然选择」的细胞培养方式获得;2)Neg7CAR:由天然存在的 CD7 阴性 T 细胞(占 CD3+T 细胞的 3%-10%)用 7CAR 进行纯化和转导后进行生产;3)KO7CAR:通过将 7CAR 转导到使用 CRISPR/Cas9RNP 敲除 CD7 基因的总 T 细胞进行制造。
在 2 周的培养期间内,NS7CAR 的细胞扩增倍数显著低于 Neg7CAR 和 KO7CAR 的扩增倍数;然而,有 87.3% 的 NS7CAR 是活细胞,使得进一步研究成为可能。在收获时,NS7CAR 组中平均 92.4% 的 T 细胞表达 7CAR 分子,显著高于 Neg7CAR 或 KO7CAR(p<0.0001)。在 7CAR 慢病毒转导三天后,NS7CAR 组中的 T 细胞发生了从 CD7+CAR-到 CD7-CAR+的快速而显著的表型转变。
一个有趣的发现是,尽管 NS7CAR 组中的 T 细胞在体外培养后用流式未检测到 CD7 的表面表达,但使用 RT-PCR 和 WesternBlot 检测到了显著的 CD7mRNA 和蛋白质的表达。与此同时,在 Neg7CAR 或 KO7CAR 细胞中未观察到 CD7mRNA 或蛋白质表达。这些结果表明,尽管 NS7CAR 表达 CD7mRNA 和蛋白质,但它们在免疫学上是 CD7 阴性的,并由于 CD7CAR 的抗原隐蔽/细胞内隔离作用而逃脱了自相残杀的细胞杀伤机制。这一点在随后的临床研究中,在 CAR-T 回输后第 28 天检测到患者体内 NS7CAR 中 CD7mRNA 的表达持续存在而被进一步证实。此外,相比 Neg7CAR 和 KO7CAR,NS7CAR 包含较多的 CD8+亚群和中央记忆表型亚群。
在体外抗白血病实验中,NS7CAR 和 KO7CAR 对 CCRF-CEM 细胞均表现出相当的细胞毒性,并释放高水平的 IFN-γ和 TNF-α,但 Neg7CAR 细胞的相应数值较低。在动物实验中,在 CAR-T 注射后的前两周内,NS7CAR 和 KO7CAR 均可显著降低小鼠模型中的白血病负担。这些数据证明了无需额外的基因编辑,直接由 7CAR 转导的总 T 细胞产生有效的 CD7CAR-T 的可行性。因此,陆道培医疗团队在 1 期临床试验中使用 NS7CAR-T 细胞,进一步探索其有效性和安全性。
临床研究
- 研究设计
本研究是 1 项开放、单臂的 1 期临床研究,目的是评估 NS7CAR 对 CD7+R/R T-ALL 或 T-LBL 患者的安全性和疗效。入组标准包括年龄在 2 至 65 岁之间的患者,既往至少接受过两线治疗后失败,且 CD7 表达 ≥ 80% 的患者。在 NS7CAR 输注后的第 28 天后,根据医生的考量和患者的意愿,允许进行巩固性异体造血干细胞移植。
- 患者基线数据
此次临床试验,共入组和回输 20 名复发或难治性 (R/R) T-ALL/T-LBL 患者,其中包含 14 名 R/R T-ALL 患者及 6 名 R/R T-LBL 患者。3 名患者为 Ph 阳性或 ETP-ALL 高危亚型;11 名患者存在高危突变或基因融合。5 名患者在入组前接受过移植。患者接受了中位数为 4.5 线的治疗。入组时,17 名患者的骨髓肿瘤细胞比例中位数为 21.49%;有 3 名 T-LBL 患者髓内未见肿瘤细胞。分别有 5 位 T-LBL 和 4 位 T-ALL 患者有髓外病灶,其中 3 名有中枢受累。
- 临床产品制备及回输
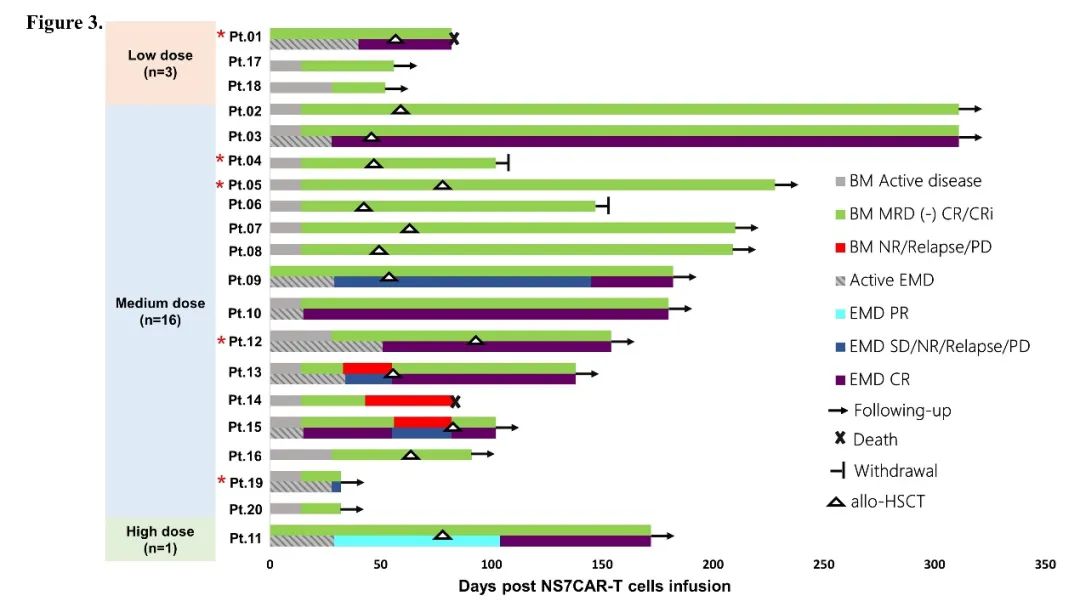
研究应用了来源于患者或其移植供者的 NS7CAR 产品。对于未接受过异基因移植的患者,使用自体 CAR-T 细胞;对于入组时为移植后复发状态的患者,在对患者进行综合评估后确定使用患者自体或移植供者来源的 CAR-T 细胞。所有患者的 NS7CAR 产品均成功制备(自体来源,n = 18;供者来源,n = 2),中位转染效率为 95.10%。NS7CAR 产品有更多的 CD8+亚群,中位 CD4/CD8 比例为 0.42。在 Day0,分别 3、16 和 1 名患者接受了低剂量(0.5×106/kg)、中剂量(1-1.5×106/kg)或高剂量(2×106/kg)的单次 NS7CAR 回输。
- 疗效及安全性
NS7CAR 展现出了良好的安全性和耐受性。1 名患者未出现 CRS;18 名患者的 CRS ≤ 2 级,仅有一名患者出现 3 级 CRS。2 名患者发生 1 级 ICANS。
同时,NS7CAR 在临床试验中展现了令人振奋的好疗效。在 Day28 时,16/17(94.12%)的骨髓受累患者实现了 MRD 阴性完全缓解;3 名仅有髓外病灶的 T-LBL 患者也继续保持了髓内 CRi 的状态。在 9 名有髓外病灶的患者中,5 名在中位时间 29 天时达到髓外 CR。两名有巨大纵隔肿物(>7 cm)的患者在第 29 天分别达到髓外部分缓解(PR)和疾病稳定(SD),其中 PR 患者在第 104 天时,其髓外病灶进一步缩小。两名有中枢神经系统浸润的患者也分别在第 15 天和第 28 天达到 CR。
至研究截止日期(2021 年 10 月 25 日),患者的中位随访时间为 142.5 天,最长达 311 天。6/20 名患者在 CAR-T 细胞回输后未接受额外的抗白血病治疗或移植,其中 4 人在 54 天的中位时间保持无疾病进展。在回输后中位时间 57.5 天,10 名 CR 患者接受了巩固性桥接移植;移植后中位随访时间为 210 天,7/10 名 CR 患者在移植后保持 MRD 阴性并持续生存。两名患者因个人原因出组,出组时均处于 CR。一名患者进行了二次移植,发展为 3 级 aGvHD,随后去世。有 4 名未达到 CR 或 CR 后复发的患者接受了挽救性移植并全部达到 CR。
- NS7CAR 的细胞动力学
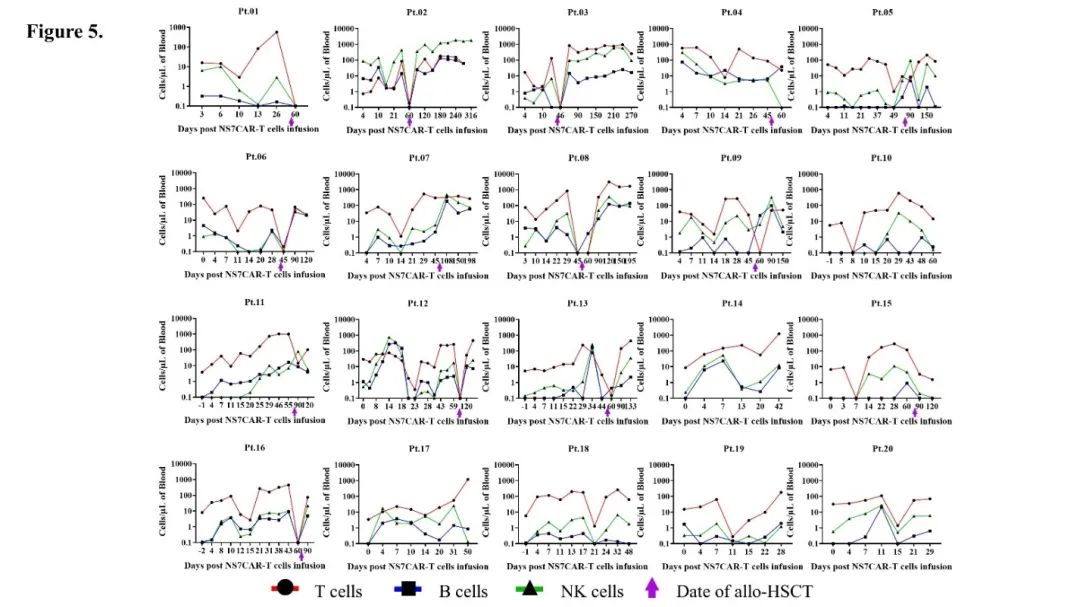
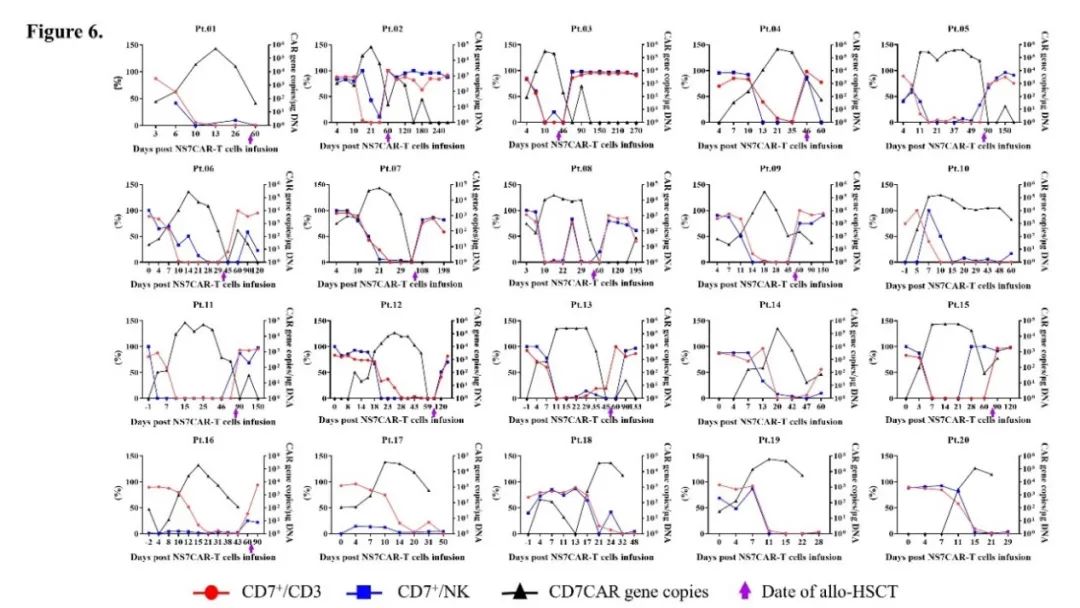
NS7CAR 扩增起始于回输后中位数 4.5 天。CAR 中位峰值拷贝数为 1.37×105copies/μg DNA,达到峰值的中位时间为 19 天。在末次随访时,NS7CAR+DNA 中位持续时间为 90 天;在移植后中位时间 39.5 天,12/14 名患者仍可通过 qPCR 检测到水平较低的 NS7CAR+DNA。对于未桥接移植的 6 名患者,CAR-T 细胞在末次随访中仍可检测到,中位持续时间为 48.5 天。用流式检测的 NS7CAR 中位峰值比例为 67.76%,最高比例达 84.71%;中位峰值时间为 17 天。
NS7CAR 回输后,患者外周血中恶性和正常 CD7+细胞的最显著减少发生在回输后中位时间第 7 天。在 CAR-T 扩增高峰,每位患者的 T/B/NK 细胞(不包括 CAR+ 和白血病 T 细胞)的绝对数量均显示出不同程度的短暂下降。NS7CAR 迅速消灭了 CD7+细胞,并主要保留了 CD7 阴性细胞亚群。T/B/NK 细胞随后恢复到基线水平,但就如所预期的,在移植后不久出现下降。在移植后,正常的 CD7+T 细胞和 NK 细胞得到充分恢复。
- 总结
该研究揭示了通过「自然选择」机制生产靶向 CD7 CAR-T 细胞的方法 (NS7CAR)。研究者发现,虽然流式无法检测到 NS7CAR-T 细胞表面上的 CD7 分子,但 NS7CAR-T 细胞继续表达 CD7mRNA 和蛋白质的水平虽然稍低,但与正常对照 T 细胞中的水平是可比的。研究认为,NS7CAR-T 细胞的 CD7 分子很可能被 CD7CAR 抗原掩盖或在胞内隔离,大大减少了 NS7CAR-T 的表面 CD7 抗原,避免了 CAR-T 细胞之间的大量自相残杀。不能排除在体外「自然选择」过程中,少部分 NS7CAR-T 细胞从自相残杀中出现的可能性。这使得 NS7CAR-T 与真正的 CD7 阴性的 Neg7CAR-T 或 KO7CAR-T 细胞形成对比。研究者提出,许多 NS7CAR-T 细胞本身并不是 CD7 阴性,而是功能性 CD7 阴性。
因此,研究者提出假设:由于 CAR 信号可能需要蛋白质复合物形成,CAR-T 细胞通过 NS7CAR-T 细胞表面的游离 CD7CAR 与靶向 T 细胞上表达的 CD7 之间的相互作用被激活,而胞内 CD7-CD7CAR 复合物不能激活 T 细胞。与 Neg7CAR 和 KO7CAR 细胞相比,细胞内 CD7CAR-CD7 相互作用是否导致 CAR 信号减弱, 并导致 NS7CAR 细胞体外扩增程度降低仍待确定。其次,自相残杀是否在 NS7CAR 减少扩增中发挥了作用还有待进一步研究。
在 NS7CAR 中,存在显著更多的 CD8+中央记忆 CAR-T 细胞,这种 CD8 偏向性可能提供更持久的疾病控制。由于 NS7CAR 的产生不涉及额外的基因编辑,避免了脱靶效应的潜在风险。因此,NS7CAR 的生物学特性和其生产的便捷十分有利于其临床应用。
迄今为止,针对 T 细胞恶性血液肿瘤的靶向 CD7 的 CAR-T 疗法仅有有限的临床试验和病例报告。NS7CAR 可由患者或供者的外周血制备,中位转染率大于 95%,且细胞活性率约 90%。由 T 系恶性血液肿瘤患者制备的自体 CAR-T 细胞的主要安全顾虑是细胞终产品中的恶性细胞污染。根据每个患者循环肿瘤细胞的表型,使用 CD3 或 CD4/CD8 选择加上 NS7CAR 的体外 "自然选择 "以及强大的抗白血病活性,可以成功地排除 NS7CAR 制备中的恶性细胞。
在该临床试验中,几乎所有患者在第 28 天时都达到了 MRD 阴性的 CR。大部分有髓外病灶的患者,包括中枢神经系统白血病患者或弥漫性髓外受累的患者,也都能达到髓外 CR。两名有巨大纵膈肿块的患者分别达到了 PR 和 SD。对于有巨大肿块的患者来说,可能需要更长的时间及联合治疗来实现 CR,因为根据 PET-CT 评估,处于 PR 的患者在第 104 天发现有进一步的临床改善。
入组该临床试验的患者曾接受了大量的既往治疗。鉴于 CD19 CAR-T 治疗的 B-ALL 患者复发率较高,而且 T-ALL/LBL 比一般 B-ALL 更具侵略性,该研究允许在缓解后进行巩固性异基因造血干细胞移植。共有 10 名骨髓和髓外 CR 患者进行了巩固性异基因造血干细胞移植,这可能限制对于 NS7CAR-T 单药治疗的持续性的评估。尽管如此,在中位随访时间超过 4.5 个月(最长 10 个月)的情况下,NS7CAR 回输后再进行异基因造血干细胞移植组没有观察到复发现象。在 6 名没有接受移植的 CR 患者中,有 4 名在最后一次随访时仍保持 CR(中位时间 1.5 个月,最长 6 个月)。然而,在一些未达到 CR 或复发的患者中,观察到 CD7 靶点丢失。
STIL-TAL1 融合基因与较高的复发率和较差的预后有关,发生在高达约 25% 的 T-ALL 患者中。在这一研究中,所有 3 名 STIL-TAL1 融合基因的患者预后都较差,有 1 名 NR 和 2 名早期复发,表明单独使用 CAR-T 疗法可能无法扭转其临床结局。一旦这类患者从 CAR-T 中获得 CR,应在治疗过程的早期考虑进行移植。
NS7CAR-T 细胞的扩增在中位第 19 天达到峰值,截至最后一次随访时,可检测到 NS7CAR-T 细胞持续存在长达 195 天。12/14 名患者在移植后中位随访时间 1.2 个月(最长 4.9 个月)时,仍可通过 qPCR 检测到低水平的 NS7CAR-T。
NS7CAR 表现出卓越的安全性,在大多数患者中只有轻微的 CRS,没有严重的神经毒性。在该临床研究方案中,早期应用托珠单抗干预管理,有可能降低严重 CRS 的发生。这种早期干预和管理可能在减少 CRS 方面发挥了作用。
两名曾有异基因造血干细胞移植史的患者在回输时使用了来自移植供者的 CAR-T 细胞,其中一位出现了轻微的皮肤排异反应。因此,应特别关注此类患者。14 名患者中有 7 名接受了后续的异基因造血干细胞移植,包括其中 2 名第二次移植的患者出现了 GvHD。虽然在这 7 名回输后出现 GvHD 的患者中仍可检测到极低水平的 CAR-T 细胞,但是不太可能是导致 GvHD 的原因。
小结
在该研究中,NS7CAR 在体外和体内均表现出强大的抗肿瘤作用。NS7CAR 的首次人体临床试验表明,无需额外的基因编辑即可防止 CD7 表达,并成功生产 NS7CAR-T 细胞。总体而言,NS7CAR 对治疗 R/R T-ALL/LBL 是安全且高效的。
好文章,需要你的鼓励













